Conférence de presse sur les avancées dans la lutte contre la maladie d'Alzheimer au Fairmont Hôtel de MONTECARLO le 31.10.2012
Conférence de Presse avec le
MONACO PRESS CLUB et A.M.P.A.
sur le thème :
AVANCEES DANS LA LUTTE CONTRE
LA MALADIE D'ALZHEIMER
Mercredi 31 Octobre 2012 à 17h30 au
FAIRMONT HÔTEL DE MONACO

Ce mercredi 31 octobre 2012 à partir de 17h30 s'est tenue une conférence de presse dans les salons du FAIRMONT HÔTEL de MONTECARLO sur le thème des "Avancées en matière médicale dans la lutte contre la redoutable maladie d'Alzheimer".
Cette conférence venait conclure, juste après trois journées de Congrès médicale "TASK FORCE" qui a réuni en Principauté de MONACO les plus grands spécialistes mondiaux en la matière, ce grave problème de la maladie d'Alzheimer qui touche une grande partie de la population mondiale dès le vieillissement parfois précoce des cellules neurologiques du "cerveau humain".
Cette conférence de presse réunissait durant près d'une heure de débat sur cette maladie, le Docteur Paul AISEN de l'Université de SAN DIEGO en Californie U.S.A. ; le Professeur Jacques TOUCHON du Centre Hospitalier Universitaire de Montpellier; le Professeur Bruno VELLAS du Centre Hospitalier Universitaire de Toulouse ainsi que le Professeur Michaël WEINAR aux U.S.A.
Pour conclure ce passionnant débat médicale où les échanges furent importants et novateurs entre les conférenciers et la salle, un Cocktail était offert par ses organisateurs à tous les participants présents à cette conférence de Presse.
DIACONESCO Gérard
Photos C. COPYRIGHTS AGENCY PRESSE INTERNATIONAL
DIACONESCO.TV - 31.10.2012 - MONACO
*************************************************************************
(Invitation)
The Jerusalem International Conference
on:
"Neuroplasticity and Cognitive Modifiability"
A scientific and intellectual challenge
on:
"The Role of Cognitive Intervention in the Shaping of Wo/Man"
Jerusalem, March 2013
Information, Call for papers, Registration
(in English, French, German, Spanish, Italian)
on the conference site:
- |
- Inscription
- |
- Contact
- |
Pourquoi nous rassemblons-nous?
Les avancées scientifiques en matière de conceptualisation et
de technologie mettent de nouveaux outils à disposition
des professionnels confrontés aux problèmes médicaux,
psychologiques, éducatifs et sociétaux de l'homme à l'échelle
mondiale. Ce congrès réunit des développements
révolutionnaires dans deux disciplines: la modifiabilité
cognitive et les neurosciences.
La Neuroscience apporte la preuve que la modifiabilité est
possible, et la modifiabilité cognitive montre comment
y arriver! Cette réunion offre l'occasion d'un rassemblement
mondial de scientifiques, de praticiens, thérapeutes et
éducateurs qui viennent de différents points de vue
professionnels, mais partagent un intérêt commun à
explorer et à se familiariser avec les développements
dans ces domaines connexes. Le thème commun est la
modifiabilité. Des développements révolutionnaires dans
les sciences du cerveau soutiennent la théorie et la
conviction selon lesquelles les fonctions et
comportements humains de base peuvent être modifiés.
Le potentiel de réponse aux besoins essentiels
Du point de vue des deux disciplines, il est
maintenant clair que l'application systématique de
l'évaluation et de l'intervention dynamique permet
de potentiellement produire un changement. La
science, et la prise de conscience croissante qu'elle a
généré, indique que les trois résistances au
changement conventionnellement acceptées peuvent
être surmontés -l'étiologie, la génétique, les causes
chromosomiques et héréditaires du handicap; les
périodes critiques, indiquant qu'il y a des délais de
développement à la suite desquels le changement n'est
pas possible, et la gravité de l'affection, indiquant
que des conditions extrêmes ne peuvent pas être améliorées.
Cependant, nous sommes à la frontière de cette
connaissance. Il y a beaucoup à apprendre pour
comprendre les implications de la convergence de
la modifiabilité cognitive et de la révolution dans les
sciences du cerveau et pour les mettre en large
acceptation et pratique.
Résultats et perspectives
Grâce à des interactions entre personnes de cultures et
de pays différents, d'un large éventail d'orientations
professionnelles, le congrès présentera les contributions
des contributeurs séminaux, et les comptes-rendus
d'action de ceux qui explorent ces nouvelles frontières.
Il s'agit d'une période critique dans le développement
de ce dialogue. Jérusalem, comme un centre d'activité
technologique et universitaire est un site approprié
pour le partage de cette connaissance et de cet espoir!
Contact: desk@brainconference.com
***************************************************************
a personal appeal from
Wikipedia founder Jimmy Wales
http://fr.wikipedia.org/wiki/Maladie_d%27Alzheimer
| Maladie d'Alzheimer | |
| Classification et ressources externes | |
| Comparaison d'un cerveau normal âgé (gauche) et du cerveau d'un patient atteint d'une maladie d'Alzheimer (droite). | |
| CIM-10 | G30, F00 |
|---|---|
| CIM-9 | 331.0, 290.1 |
| OMIM | 104300 |
| DiseasesDB | 490 |
| MedlinePlus | 000760 |
| eMedicine | neuro/13 |
| MeSH | D000544 |
| GeneReviews | alzheimer |
La maladie d'Alzheimer est une maladie neurodégénérative (perte progressive de neurones) incurable du tissu cérébral qui entraîne la perte progressive et irréversible des fonctions mentales et notamment de la mémoire. C'est la forme la plus fréquente de démence chez l'homme. Elle fut initialement décrite par le médecin allemand Alois Alzheimer en 19061.
Les causes exactes de la maladie d'Alzheimer restent encore inconnues. Des facteurs génétiques et environnementaux contribueraient à son apparition et à son développement. Il existe cependant des facteurs de risques connus : certaines anomalies génétiques, des facteurs de risque cardio-vasculaires ou encore l'intoxication à certains métaux lourds.
Le premier symptôme est souvent des pertes de souvenirs (amnésie), se manifestant initialement par des distractions mineures, qui s'accentuent avec la progression de la maladie. Les souvenirs plus anciens sont cependant relativement préservés. L'atteinte neurologique s'étend par la suite aux cortex associatifs frontaux et temporo-pariétaux, se traduisant par des troubles cognitifs plus sévères (confusions, irritabilité, agressivité, troubles de l'humeur et des émotions, des fonctions exécutives et du langage) et la perte de la mémoire à long terme. La destruction des neurones se poursuit jusqu'à la perte des fonctions autonomes [réf. nécessaire] et la mort 2.
Le diagnostic de la maladie d'Alzheimer repose essentiellement sur l'interrogatoire, des tests neuropsychologiques et sur la mise en évidence d'une atrophie corticale qui touche d'abord le lobe temporal interne et notamment l'hippocampe, régions importantes pour la mémoire. Elle est généralement diagnostiquée à partir de l'âge de 65 ans3. Des formes précoces, plus rares (moins de 5 % des patients), peuvent cependant apparaître beaucoup plus tôt. Les premiers signes de la maladie d'Alzheimer sont souvent confondus avec les aspects normaux de la sénescence, une dépression, un stress ou d'autres pathologies neurologiques comme la démence vasculaire. Elle fut ainsi sous-diagnostiquée jusque dans les années 1960.
La vitesse et l'évolution de la maladie sont variables d'un individu à l'autre, ce qui rend difficile tout pronostic précis. L'espérance de vie varie ainsi de 3 à 8 ans selon l'âge du patient au moment du diagnostic4,5. Avec l'évolution de la maladie, les patients souffrent parfois de rejet de la part de la société et de leur famille6,7.
Il n'y a actuellement pas de traitement qui diminue la progression de cette maladie. Les soins proposés sont principalement d'ordre palliatif et n'ont qu'un effet limité sur les symptômes. La stimulation cognitive, l'exercice physique et un régime alimentaire équilibré pourraient retarder l'apparition de troubles cognitifs chez les personnes âgées8. Parce que la maladie d'Alzheimer ne peut être guérie et qu'elle est dégénérative, le patient s'appuie sur les autres pour l'aider. Le rôle de l'aidant principal est primordial9 ,10,11,12.
La maladie d'Alzheimer touchait environ 26 millions de personnes dans le monde en 2005 et pourrait en toucher quatre fois plus en 205013, ce qui équivaudrait alors à 1 personne sur 8514. Dans les pays développés, la maladie d'Alzheimer est l'une des pathologies les plus coûteuses pour la société15,16.
Étant donné la prévalence de la maladie, un important effort est mené par la recherche médicale pour découvrir un médicament qui permettrait de stopper le processus neurodégénératif. La principale piste de recherche vise à s'attaquer aux plaques amyloïdes qui se forment entre les neurones au cours de la maladie et aux agrégats de protéines tau formant les dégénérescences neurofibrillaires à l'intérieur des neurones.
Sommaire |
Stades d'évolution
La progression de la maladie d'Alzheimer est divisée en 4 stades, avec une progression caractéristique de troubles cognitifs.
Les premiers symptômes sont souvent confondus avec les effets normaux du vieillissement ou du stress6. Des tests neuropsychologiques poussés peuvent cependant révéler des problèmes cognitifs légers jusqu'à huit ans avant que la personne ne remplisse les critères diagnostiques de la maladie d'Alzheimer17. Ces premiers symptômes affectent principalement les activités les plus complexes de la vie quotidienne18. Le déficit le plus notable est la perte de mémoire, qui se manifeste par des difficultés à se souvenir des faits récemment appris et à acquérir de nouvelles informations17,19. Des problèmes plus subtils au niveau des fonctions exécutives comme l'attention, la planification, la flexibilité et l'abstraction ou encore des défauts de mémoire sémantique (mémoire du sens des mots et des concepts) sont également évocateurs des stades précoces de la maladie d'Alzheimer17. Une apathie peut être observée dès ce stade et reste le symptôme le plus persistent à travers l'évolution de la maladie20.
Cette caractéristique préclinique de la maladie est également appelée trouble cognitif léger19. Cependant, le fait qu'il corresponde avec certitude au premier stade de la maladie d'Alzheimer reste controversé21.
Chez les personnes souffrant réellement de la maladie d'Alzheimer, la progression des problèmes de mémoire et d'apprentissage permet de confirmer le diagnostic définitif. Chez une partie de ces patients, d'autres symptômes sont plus proéminents que les problèmes de mémoire, notamment les problèmes liés au langage, aux fonctions exécutives, à la perception (agnosie) ou encore à l’exécution des mouvements (apraxie)22.
La maladie d'Alzheimer n'affecte pas de façon égale toutes les formes de mémoire. En effet, étant contrôlées par des structures cérébrales différentes, elles ne sont pas détériorées à la même vitesse par la maladie. Les formes de mémoire à long terme, comme la mémoire épisodique (les souvenirs de la vie de la personne), la mémoire sémantique (les faits appris, comme une date de naissance) et la mémoire implicite (mémoire des gestes, comme faire du vélo) sont moins affectées que celle gérant l'apprentissage de souvenirs et de faits nouveaux23,24.
Les problèmes de langage (aphasie progressive primaire) sont caractérisés majoritairement par une diminution du vocabulaire et de la fluidité du discours, ce qui conduit à un appauvrissement de l'expression orale et écrite22,25. A ce stade, la personne touchée par Alzheimer est cependant toujours capable de communiquer des idées simples de manière adéquate22,25,26.
De même, bien que la personne reste capable de réaliser des tâches motrices fines, comme l'écriture, le dessin ou l'habillement, certaines difficultés apparaissent dans la coordination et la planification des mouvements (apraxie) mais sont rarement remarquées22. A ce stade de la progression de la maladie, la personne reste indépendante lors des tâches courantes, mais va requérir de l'assistance ou de la supervision pour les activités compliquées22.
La détérioration progressive des différentes fonctions cognitives conduit finalement à la perte d'indépendance : lorsque le sujet n'est plus capable de réaliser seul les activités les plus courantes22. Les difficultés du langage deviennent évidentes lorsque l'incapacité à se rappeler du vocabulaire (aphasie anomique) conduit le patient à effectuer des substitutions incorrectes de mots (paraphasie) de plus en plus fréquentes. Les capacités de lecture et d'écriture se perdent progressivement22,26. Avec la progression de la maladie, les séquences motrices complexes deviennent moins coordonnées, ce qui augmente les risques de chutes22. Durant ce stade, les problèmes de mémoire s'aggravent et la personne peut commencer à ne plus reconnaitre ces proches22. La mémoire à long terme, jusque-là épargnée, commence à se détériorer22.
Les changements comportementaux et neuropsychiatriques deviennent prévalents. Les manifestations classiques sont des errements, de l'irritabilité et une labilité émotionnelle qui conduit à des pleurs, des poussées d'agressivité soudaines ou de la résistance irrationnelle au soin22. Des périodes de grande confusion ont tendance à apparaitre, notamment lors au coucher du soleil (la luminosité influant sur le caractère)27. Environ 30% des patients Alzheimer développent des symptômes délirants et notamment des délires de changements d'identité22. Les patients perdent également la conscience de leur maladie et des limitations qu'elle entraine (anosognosie)22. Enfin, ils peuvent souffrir d'incontinence urinaire22. Ces différents symptômes peuvent créer un stress important chez les proches et l'aide soignant, stress qui peut être réduit en passant d'un soin à domicile au placement en maison de soin spécialisées22,28.
Durant la phase finale de la maladie d'Alzheimer, le patient est complétement dépendants du personnel de soin22. Le langage est réduit à quelques phrases simples ou même seulement des mots, ce qui conduit finalement à une perte complète de la parole22,26. Malgré cette perte des capacités verbales, les personnes perçoivent encore les émotions de leur vis-à-vis et sont capables d'y répondre par des signes émotionnels22. Une certaine agressivité peut encore être présente, mais le plus souvent les conséquences de la maladie sont une extrême apathie couplée à un état de fatigue constant22.
Les patients les plus avancés ne sont plus capable d'effectuer la moindre tâche motrice sans assistance22. La musculature et la mobilité sont détériorées au point que le patient reste alité et ne peut plus se nourrir seul22. La maladie d'Alzheimer est une maladie terminale, mais la cause de la mort est souvent due à un facteur externe, comme une infection des escarres ou une pneumonie, plutôt que la maladie elle-même22.
Mécanismes pathologiques
Lors de la maladie d'Alzheimer, le cerveau du patient est victime d'un double processus de dégénérescence et d’inflammation. Il est caractérisé par deux types de lésions, chacune causée par une accumulation de protéines qui entraîne un dysfonctionnement de la cellule. Les progressions différentes de ces deux types de lésion participent à une lésion plus globale du cerveau :
- Au niveau extracellulaire, l'accumulation du peptide β-amyloïde provoque des plaques amyloïdes.
- Au niveau intracellulaire, l'accumulation de protéine Tau s'appelle neurofibrilles.
La maladie d'Alzheimer est caractérisée par une perte de neurone et de synapse dans le cortex cerebral et certaines régions subcorticales. Cette perte anormale entraine une atrophie des régions affectées, incluant le lobe temporal, parietal et de parties du cortex frontal et du gyrus cingulé29. Le cerveau peut ainsi perdre 8 à 10 % de son poids tous les dix ans, contre 2 % chez un sujet sain. L'atrophie corticale s'accompagne d'une dilatation des ventricules cérébraux et des sillons corticaux ainsi que d'une perte neuronale affectant particulièrement le système cholinergique (noyau basal de Meynert, septum, cortex entorhinal, amygdale et hippocampe).
Les études utilisant l'IRM et le PET-scan ont documenté une reduction de certaines régions spécifiques chez les personnes atteintes de la maladie d'alzheimer lorsqu'elle progressent d'un trouble cognitif léger à la maladie d'Alzheimer et en comparaison des images de sujets sains agés30,31.

Les plaques amyloïdes correspondent à l'accumulation extracellulaire d’un peptide appelé « β-amyloïde » ou « peptide Aβ42 » (42, parce que constituée de 42 acides aminés). Cette protéine est une forme clivée anormale d'une glycoprotéine membranaire appelée « protéine précurseur de la protéine β-amyloïde » (ou APP pour Amyloïd Protein Precursor). C'est une enzyme, la β-secretase, qui provoque, pour des raisons encore mal comprises, le clivage anormal de la protéine APP. En temps normal cette protéine de la membrane des neurones est clivée par des secretases en peptide p. 3 non toxique.
Le peptide Aβ42 est un peptide insoluble qui ne peut être dégradé efficacement par les cellules environnantes. Il s'accumule dans le milieu extracellulaire, formant des plaques séniles qui compriment les neurones. Le peptide β-amyloïde est donc une protéine neurotoxique.
La présence de plaques amyloïdes entraîne un dysfonctionnement des neurones environnants, puis la mort neuronale par apoptose ou par nécrose.
Les plaques séniles libèrent de l'eau oxygénée, un peroxyde de formule H2O2, et entraînent un stress oxydatif sur les neurones environnants. Dans l'H2O2, la liaison entre les deux atomes d'oxygène étant très faible, elle va rapidement se cliver. Deux molécules OH° (hydroxyles), des radicaux libres, sont ainsi produits. Les radicaux libres ne respectent pas la règle de l'octet. Ils sont donc instables car ils vont chercher à coupler leur électron libre. Pour ce faire, ils vont arracher un atome d'hydrogène à la membrane du neurone (composée de molécules carbonées présentant de nombreux atomes d'hydrogène). La membrane « trouée » va donc laisser pénétrer d'autres radicaux libres qui s'attaqueront à l'ADN du neurone, entraînant la destruction des fonctions de la cellule privée d'information génétique. Dans le corps neuronal proprement dit, la membrane étant abîmée par les radicaux libres, les ions calcium et des fragments ß-amyloïdes vont également pénétrer et activer les phosphokinases à calcium (PKC) dont le rôle est d'éliminer la membrane neuronale abîmée. La PKC suractivée va éliminer des portions de membrane saines et accélérer le processus de destruction. Les radicaux libres et les fragments d'Aß42 vont pénétrer en surnombre dans le corps du neurone, affecter son fonctionnement et contribuer à l'apoptose.
D'autre part, le stress oxydatif provoque une réaction inflammatoire par le recrutement de la microglie qui va accélérer la destruction des neurones.
L'apparition de plaque amyloïde peut être dû au vieillissement normal. L'accumulation anormale sous-jacente à la maladie d'Alzheimer reste cependant inexpliquée. La responsabilité de toxiques est suspectée, tels que le mercure lorsqu'il est accumulé dans le cerveau sous sa forme ionisée divalente (Hg2+)- pro-oxydante et à forte affinité pour les groupements soufrés thiols[précision nécessaire].
Le seul facteur de risque connu est un facteur génétique. Il concerne une autre protéine qui agirait dans le processus de formation des plaques amyloïdes : l’apolipoprotéine E. Cette protéine est codée par un gène qui présente trois allèles possibles chez l'homme : E2, E3 et E4. Les allèles E2 et E3 sont spécifiques de l’espèce humaine. Ils proviennent d’une mutation du gène E4. L’allèle le plus répandu est l’allèle E3 (70 %), suivi de l’allèle E4 (20 %) puis de l’allèle E2 (10 %). Les allèle E2 et E3 sont associés au mécanisme de croissance neuritique (formation des axones et des dendrites). Cette croissance est importante pour la plasticité neuronale, un mécanisme assurant le bon fonctionnement et la longévité du système nerveux. Au contraire, l'allèle E4 inhibe la croissance neuritique, diminue la plasticité neuronale et est par conséquent associé aux maladies du dysfonctionnement neuronal. Or, la présence d'un allèle E4 serait entre autre associé à un risque de formation des plaques amyloïdes.
Les plaques amyloïdes sont principalement localisées dans le néocortex et l'hippocampe
La protéine Tau est une macromolécule essentielle à la stabilité de la tubuline, protéine constituant majoritairement l'assemblage des microtubules qui forment le cytosquelette des axones. Les protéines tau se positionnent perpendiculairement à l'axone et assurent la rigidité des microtubules et le bon transport axonal.
Normalement, des protéines Tau se détachent périodiquement des microtubules, mais sont remplacées et rapidement dégradées chez le sujet sain. La maladie d'Alzheimer est caractérisée par des protéines Tau se détachant des microtubules et restant dans le milieu intracellulaire. Elles ne sont pas toutes dégradées et vont donc s'agréger. C'est cela qui va former les neurofibrilles. Trop de neurofibrilles bloquent le fonctionnement du neurone car elles ne permettent pas le transport axonal nécessaire à son activité. Les neurofibrilles compriment le neurone et provoquent une mort neuronale par apoptose.
Il existe plusieurs explications au détachement des protéines Tau, la principale reposant sur un problème de phosphorylation. La protéine tau est normalement peu phosphorylée. Lorsqu'elle est très phosphorylée, elle ne peut pas s'attacher aux microtubules. Dans la maladie d'Alzheimer, les protéines tau seraient hyperphosphorylée. Elles se détachent, se conforment en paire de filaments hélicoïdaux pathologiques et s'accumulent en formant des neurofibrilles. La cause de l'augmentation de la phosphorylation est inconnue. Une hypothèse avance que les radicaux libres, dus à la présence de plaques amyloïdes, détériorent la paroi membranaire des axones et laissent ainsi pénétrer des ions calcium qui vont sur-activer les Map kinases chargées de contrôler la phosphorylation des protéines tau. Ces protéines vont donc recevoir 5 à 9 groupements de phosphates, au lieu de 2 à 3, et leur schéma de construction va changer.
Les coupures protéolytiques des protéines tau, qui sembleraient intervenir de façon précoce et seraient un événement concomitant à l'hyperphosphorylation de ces protéines.
Comme pour toutes les protéines, il existe un gène qui code la protéine Tau. Le gène présente notamment un motif appelé motif R qui permet à la protéine tau de se fixer sur les microtubules. Le gène tau a sept allèles différents qui peuvent être classés en deux catégories selon le nombre de motif R qu'ils possèdent:
- ceux à trois motifs R ;
- ceux à quatre motifs R.
Les protéines tau qui proviennent des allèles à trois motifs R ont une fixation moins importante que les protéines qui proviennent des allèles à quatre motifs.
La majorité des cas de maladie d'Alzheimer sont dits sporadiques, ils ne sont pas héréditaires, bien que la présence de certains gènes soit un facteur de risque.
Cependant, environ 0,1% des cas sont des formes génétiques familiales à transmission autosomale dominante (non-liée au sexe) qui se déclenchent habituellement vers 65 ans34. Cette forme de la maladie est connue comme la maladie d'Alzheimer familiale précoce (Early onset familial Alzheimer's disease).
La majorité de ces formes familiales autosomales dominantes peuvent être attribuées à une mutation sur un des trois gènes suivants35 :
- Le gène précurseur de la protéine amyloïde (APP), situé sur le chromosome 21 (cinq mutations du codon 717 sont connues)
- Le gène Preseniline 1 (PSEN1) situé sur le chromosome 14 (principalement des mutations faux sens)
- Le gène Preseniline 2 (PSEN2)
La plupart des mutations de ces trois gènes provoque une augmentation de la production de l'Aß42, le composant des plaques séniles amyloïdes36. Certaines mutations affectent uniquement le ratio entre la forme Aß42 et la forme normale Aß40, sans affecter le niveau de la protéine Aß42 elle-même36,37. Cela suggère que les mutations de la preseniline peuvent causer la maladie même lorsqu'elle diminue la quantité totale d'Amyloïde-ß, ce qui suggère un rôle de cette protéine à un autre niveau du mécanisme pathologique que sur le seul fragment Aß (ex: sur l'APP ou sur un autre fragment)
Un des facteurs de risques génétiques les mieux décrits est la possession de l'allèle ε4 du gène de l'apolipoprotéine E (APOE)38,39. Entre 40 et 80% des personnes touchées par la maladie d'Alzheimer possède au moins une allèle APOEε439. La présence de allèle APOEε4 augmente le risque de la maladie de trois fois à l'état hétérozygote et de quinze fois à l'état homozygote34. Seulement ce risque ne peut être uniquement expliquer par la génétique. Par exemple certaines populations nigérianes ne présentent aucune relation entre la présence de l'APOEε4 et l'incidence ou l'âge de déclenchement de la maladie d'Alzheimer40,41,35. Les généticiens s'accordent sur le fait que de nombreux autres gènes sont également des facteurs de risque ou au contraire ont un effet protecteur et influent donc sur le déclenchement des formes tardives d'Alzheimer. Néanmoins, des études comme celle effectuée au Nigeria et la pénétrance incomplète des facteurs de risque génétiques associés aux formes sporadiques indique une très forte influence de l'environnement. L'influence de plus de 400 gènes différents a été testé35, la plupart sans donné de résultats34
- Les personnes porteuses de trisomie 21 (syndrome de Down)42,43,44.
- Gène de la clusterine45.
- Gède codant la protéinePICALM (phosphatidylinositol-binding clathrin assembly protein) contribuant au système immunitaire,
- CR1 (récepteur 1 du composant 3b/4b du complément) a aussi été ajouté fortement suspecté46.
Diagnostic
La maladie d'Alzheimer ne peut pas être diagnostiquée avec certitude. Seule l'autopsie, après le décès du patient, permet de confirmer avec certitude le diagnostic de maladie d'Alzheimer, grâce à un examen anatomo-pathologique du cerveau. Le recours à des biopsies de tissu cérébral est dangereux et s'avère peu utile. Le diagnostic de maladie d'Alzheimer est néanmoins donné lorsqu'un diagnostic clinique de démence est établi et que les examens complémentaires éliminent l'ensemble des autres diagnostics possibles (diagnostic par défaut)[réf. nécessaire].
Actuellement, il n'est pas recommandé de recourir au dépistage de la maladie, c'est-à-dire à la recherche de la maladie chez des personnes qui n'ont aucun symptôme47. En effet, en l'absence de traitement curatif, cette stratégie n'est pas pertinente au plan de la santé publique. Par contre, il est recommandé de reconnaître la maladie chez des personnes qui ont des symptômes ou des signes évocateurs. Il est alors question de détection et de diagnostic.
Moins de 1 %48 des malades présentent une maladie d'Alzheimer d'origine purement génétique. Cette forme se caractérise par l'apparition des signes avant 30 ans :
- une transmission autosomique dominante (la moitié de chaque génération est atteinte).
Deux mutations de gènes sont impliquées et peuvent être détectée chez le patient :
- une mutation du gène APP située sur le chromosome 21 qui code un précurseur de la protéine amyloïde (cinq mutations du codon 717 sont connues) ;
- une mutation du gène PSEN1 située sur le chromosome 14 (nombreuses mutations qui sont des mutations faux sens).
La maladie d'Alzheimer débute habituellement par des troubles de la mémoire. Certains patients remarquent que leur mémoire fonctionne moins bien qu'autrefois et consultent leur médecin pour cela. Chez d'autres patients, l'entourage plus que le patient lui-même remarque ses difficultés de mémoire. Les symptômes liés à la mémoire (plainte mnésique) ne sont pas spécifiques de la maladie d'Alzheimer (voir diagnostics différentiels)
On peut retrouver des signes précurseurs 12 ans avant le diagnostic49. Une autre étude portant sur 10 000 personnes suivies dans 3 villes françaises doit vérifier si des signes encore plus précoces peuvent être détectés [réf. nécessaire].
La maladie d'Alzheimer peut aussi se manifester par des symptômes autres que ceux liés à la mémoire. Une dépression peut être un des premiers signes. Une perte d'indépendance fonctionnelle définie par la nécessité d'une aide humaine dans les gestes de la vie quotidienne est aussi une situation qui doit faire évoquer cette maladie. D'autres circonstances de découverte sont possibles : chutes répétées, amaigrissement, troubles du comportement.
À un stade plus évolué (à partir du deuxième stade), d'autres troubles cognitifs apparaissent progressivement : altération du langage, des gestes et de la motricité, altération de la communication.
Le diagnostic de la maladie d'Alzheimer en centre spécialisé est posé en 2 étapes : la première étape recherche l'existence d'un syndrome démentiel par un médecin pas forcément spécialisé ; la seconde étape, réalisée seulement en cas de démence, consiste à rechercher la cause du syndrome démentiel. Pour poser le diagnostic de démence, il est nécessaire de conduire une évaluation détaillée des fonctions cognitives qui est habituellement réalisée par un psychologue spécialisé en neuropsychologie.
Le terme démence est utilisé pour exprimer une détérioration mentale générale et chronique. La démence n'est qu'une description de la façon dont le patient se présente devant le praticien, et de nombreuses maladies peuvent en être la cause. La maladie d'Alzheimer est l'une des formes de démence provoquées par une anomalie biochimique. Il existe d'autres formes de démence comme, parmi d’autres, la chorée de Huntington, la maladie de Parkinson, la paralysie supranucléaire progressive, les encéphalites50.
Les critères de démence du DSM-IV reposent sur l'installation de troubles intellectuels portant de manière partielle ou complète sur :
- la mémoire : amnésie des faits récents puis anciens,
- des troubles des fonctions exécutives (c'est-à-dire d'organisation et de réalisation d'une tâche complexe, par exemple remplir sa feuille de déclaration de revenus),
- des troubles du langage (aphasie amnésique) caractérisés par des « oublis du mot »,
- des troubles de la praxie: apraxie (c'est-à-dire de réalisation de gestes complexes : par exemple utiliser la machine à laver),
- une agnosie (troubles de reconnaissance) : par exemple de panneaux routiers, puis de visages etc.
Ces troubles ont un retentissement socio-professionnel. Leur évolution se fait de manière progressive et irréversible (déclin continu, etc.).
Ces signes ne peuvent être expliqués par d'autres causes : ni organique (tumorale, infectieuse, toxique), ni psychique (dépression, schizophrénie), et en dehors d'une confusion aiguë.
Le diagnostic de maladie d'Alzheimer nécessite l'évaluation de plusieurs fonctions cognitives. Certaines perturbations sont en faveur du diagnostic.
- le test Codex : ce test réalisable en 3 minutes combine une épreuve de mémoire et un test de l'horloge : ces éléments forment un arbre de décision complété pour certains patients par des questions sur l'orientation spatiale. Il est redondant avec les 3 tests ci dessous (réalisé en routine en gériatrie hospitalière) mais il est plus rapide et particulièrement adapté à la médecine de ville 51.
- le MMSE (Mini Mental State Evaluation, ou Test de Folstein), est le test le plus répandu. Il comporte 18 questions ou tâches et il est réalisable en 15 minutes environ. Il fournit un score variant de 0 à 30 points : un score inférieur à 24 sur 30 est suspect de démence ; un score de 28 ou plus est normal. Ce résultat doit cependant être interprété selon le niveau éducatif du patient car un haut niveau peut améliorer le score et donc fausser le test (quel est son dernier diplôme obtenu, quel est son (ancienne) activité professionnelle). Il faudra s'assurer de l'absence de confusion avant sa réalisation. Il est recommandé de ne pas faire ce test dès l'arrivée des patients dans le services mais à distance de quelques jours [réf. nécessaire].
- le test de l'horloge 52: il consiste à faire dessiner à la personne le cadran d'une montre. On demande au patient d'indiquer une heure choisie par l'examinateur. Par exemple mettez une petite aiguille et une grande aiguille pour indiquer cinq heures moins le quart. Il est réalisable en 2 minutes environ.
- le test des 5 mots de Dubois 53: ce test évalue la mémoire en distinguant les processus d'encodage et de rappel.
Outre les tests précédents, on peut citer
- le test de Gröber et Buschke pour explorer la mémoire
- le test Trail Making Test54, pour explorer les fonctions exécutives et l'attention [réf. nécessaire]
- le test de Stroop pour explorer l'attention
- les test de dénomination, pour explorer le langage [réf. nécessaire]
- la copie de figures complexes (ex: La figure complexe de Rey) [réf. nécessaire]
Le diagnostic de démence est uniquement clinique et ne nécessite pas d'examen complémentaire. Ces derniers sont utiles pour rechercher l'origine de la démence et chercher des causes curables.
Certains examens sont réalisés de façon courante :
- L'IRM est l'examen d'imagerie de choix pour le diagnostic étiologique des démences. Dans la maladie d'Alzheimer, elle peut montrer une atrophie corticale (particulièrement hippocampique), cependant (atrophie corticale ou sous-corticale) se voit dans d'autres maladies de la personne âgée. Cet examen permet aussi d'éliminer notamment d'autres causes : tumeurs, accident vasculaire cérébral, hématome intra-cérébral ou sous-dural, encéphalopathie éthylique. Des indices sont cependant en cours d'évaluation pour tenter de faire un diagnostic précoce (dont la diminution de la taille de l'hippocampe). Cependant cet examen est peu accesible, son coût est élevé et son délais d'attente est long.
- Le scanner cérébral est réalisé si l'IRM est contre-indiquée ou n'est pas réalisable. Son coût est faible et son délais d'attente est court
- Les dosages plasmatiques de la vitamine B12 et de la vitamine B9 (folates), ainsi qu'un bilan thyroïdien (TSH) sont systématiquement réalisés, car une carence en vitamine B12 ou B9 et une hypothyroïdie peuvent être causes de démence (démence curable).
D'autres examens sont réalisés dans certaines circonstances seulement :
- Le dosage dans le liquide céphalo-rachidien de la protéine tau, des protéines tau phosphorylées et du peptide amyloïde bêta de 42 acides aminés sont réalisés après une ponction lombaire. Ces dosages ne sont pas réalisés en pratique courante car ils sont pratiqués lorsque le diagnostic étiologique de la démence est incertain. Ils sont réalisés dans certains centres hospitaliers spécialisés.
- La tomographie à émission de positons ou TEP est un examen permettant l'analyse de certains traceurs radioactifs injectés dans l'organisme qui sont des marqueurs de la perfusion ou du métabolisme. On note une diminution assez nette du métabolisme de plusieurs parties du cerveau (lobe temporal, pariétal et postérieur) avec une bonne sensibilité et spécificité [réf. nécessaire]. La diminution de l'activité de l'hippocampe serait un indice prometteur. Cet examen n'est pas réalisé de façon courante. Il est utilisé lorsque le diagnostic étiologique de la démence est incertain, malgré l'évaluation clinique et l'IRM. La TEP peut aussi être utilisée avec des traceurs qui se lient aux plaques amyloides (PIB). Ce type d'examen est réalisé dans le cadre de protocoles de recherche.
- La tomographie à émission monophotonique (TEMP) utilise aussi des marqueurs de perfusion ou du métabolisme cérébral. Cette imagerie fonctionnelle est utile pour le diagnostic étiologique des démences, lorsque les données cliniques ou d'imagerie IRM ne suffisent pas à poser le diagnostic. En particulier, la TEMP est utile pour identifier les démences fronto-temporales. La TEMP peut aussi être réalisée avec des traceurs du système dopaminergique : c'est le Dat-scan, un autre examen d'imagerie isotopique utile pour différencier la maladie d'Alzheimer de la démence à corps de Lewy, une autre démence dégénérative. Dans cette maladie, il y a une hypofixation du traceur au niveau du striatum (zone de fixation normale pour cet examen). La Dat-scan utilise un traceur fixant spécifiquement les transporteurs de la dopamine marquée à l'iode 123.
|
|
Cet article, ou cette section, doit être recyclé(e).
Une réorganisation et une clarification du contenu sont nécessaires. Discutez des points à améliorer en page de discussion.
|
On peut évoquer le diagnostic de maladie d'Alzheimer devant beaucoup de situations qui différentes.
Au stade initial de la maladie, un oubli bénin lié à l'âge, un déficit cognitif léger ou mild cognitive impairment (MCI),
- troubles cognitifs induits par des médicaments : psychotropes (benzodiazépines, traitements anticholinergiques ou tout autre médicament
- Des troubles anxieux, une dépression sont également observé. en fait, ces troubles, notamment la dépression, sont parfois associés à la maladie d'Alzheimer. Dans certains cas, pour faire la part des choses, il faut entreprendre le traitement antidépresseur d'épreuve durant un temps suffisant et suivre l'évolution ; la persistance des troubles cognitifs indique qu'il s'agit bien d'une démence[réf. nécessaire].
- la démence associée à la maladie de Parkinson évoqué devant des troubles moteurs,
- syndrome d'apnée du sommeil évoqué devant des ronflements, une somnolence et un surpoids
- Syndrome confusionnel
- surmenage,
- Un trouble métabolique (hypoglycémie, hyponatrémie, hypothyroïdie)
- autres formes de démences d'origine dégénératives, notamment la démence à corps de Lewy,
- les démences frontotemporales,
- la paralysie supranucléaire progressive, cette dernière démence rare étant une taupathie (ou tauopathie) « pure » dans la mesure où seule la protéine tau semble impliquée.
- Les démences dites secondaires (à un trouble organique), dont la plus fréquente est la démence vasculaire. Certains patients ont un tableau de maladie d'Alzheimer et des signes cliniques et/ou radiologiques de lésions cérébrales d'origine vasculaire. Il est alors question de démence mixte ou encore de maladie d'Alzheimer avec lésions cérébrovasculaires.
- encéphalopathie spongiforme bovine. Elle nécessite cependant une enquête alimentaire pour éviter la récidive chez d'autres personnes.
Facteurs de risque
Le premier facteur de risque est l'âge essentiellement (supérieur à 65 ans),
Les maladies cardiovasculaires relativement précoces (à partir du milieu de vie)55,56,57,58 peuvent être un facteur de risque.
Un traitement contre l'hypertension limite le risque de mourir précocément, mais aussi celui d'être admis pour une longue durée dans un centre de soins (risque diminué de 49 %), pour des raisons encore incomprises. De manière générale, l'hypertension est un facteur de risque de démence59. Certains se demandent même si la MA n'est pas une maladie vasculaire plutôt que neurodégénérative60, notamment liée à une hypoperfusion cérébrale61 et à une mauvaise irrigation du cerveau62, comme dans d'autres formes de démence peut-être63.
L'isoforme 4 de l'apolipoprotéine E et l'hypercholestérolémie64 sont également des facteurs. Un régime riche en acides gras polyinsaturés oméga-3 et omega-6, et pauvre en acides gras saturés65 Le gène de l'apolipoprotéine E est présent sous trois formes alléliques : l'APOE2, APOE3, et APOE4. Le premier se rencontre dans 51 % de la population, le deuxième se rencontre dans 80 % de la population et le troisième se rencontre dans 15 % de la population ; la présence de l' APOE4 sous la forme hétérozygote (1 allèle APOE4) multiplie par 2 le risque de maladie d'Alzheimer (par rapport aux personnes ne possédant pas cet allèle) ; la présence de l' APOE4 sous la forme homozygote (2 allèles APOE4) multiplie par 11 le risque de maladie d'Alzheimer (par rapport aux personnes ne possédant pas cet allèle).
Cette apolipoprotéine E interviendrait dans les mécanismes de réparation neuronale.
Le tabagisme augmenterait sensiblement le risque de survenue de la maladie d'Alzheimer66.
Les antécédents personnels de dépression[réf. nécessaire], de traumatisme crânien (coups, secousses importantes, etc.)[réf. nécessaire]. Il a été question que l'exposition à l'aluminium soit aussi en cause, mais cette hypothèse est en déclin et a toujours été controversée,
|
|
Cet article, ou cette section, doit être recyclé(e).
Une réorganisation et une clarification du contenu sont nécessaires. Discutez des points à améliorer en page de discussion.
|
Certains indices suggèrent une relation causale entre l'exposition au mercure et la maladie d'Alzheimer67. En revanche, les amalgames dentaires contenant du mercure ont fait l'objet de nombreuses études qui n'apportent pas la preuve de leur responsabilité au regard des maladies neurodégénératives68,69
Ce mercure aurait pour principale origine les plombages dentaires : l’OMS considère que le mercure-vapeur émis par les amalgames dentaires est la 1re source d’exposition mercurielle des populations occidentales70. Les amalgames perdent environ 50 % de leur mercure (soit 1/2 gramme environ par amalgame), en 10 ans, avant stabilisation, et de nombreuses études récentes ont confirmé que le taux de mercure du cerveau est corrélé au nombre d’amalgames71,72,73,74,75.
Une revue76 (des connaissances et études récentes, faite par J. Mutter montre une grande cohérence des études disponibles. Boyd Haley et ses collègues (Université du Kentucky) ont récemment montré comment le mercure induit une neurodégénérescence caractéristique de la MA, à la suite d'une exposition chronique à de faibles doses de mercure-vapeur77.
Une étude (de faible puissance statistique[réf. nécessaire] et portant sur des vétérans de l'US Army) avait en 1993 mis en évidence un taux 7 à 8 fois plus élevé de caries racinaires chez les victimes de maladie d'Alzheimer par rapport à un groupe témoin (apparié pour l’âge et le niveau d’éducation)78. Le mercure inhalé passe le mieux et plus directement au travers des poumons et qu'il est facilement stocké dans le cerveau qu'il gagne aisément grâce à sa lipophilie partielle. Ce sont les cellules gliales qui le stockent durablement, pour des dizaines d'années, sous forme d'un complexe insoluble soufré de cations mercuriques (Hg2+), après qu'il y a été oxydé par le peroxyde d’hydrogène dans une réaction catalysée par une catalase (la peroxydase).
En 2006, une étude suédoise montrait que les Suédois victimes de la maladie d'Alzheimer avaient plus souvent des problèmes dentaires que les non-malades79.
Chez le rat de laboratoire exposé à du mercure, des processus de dégénérescence du cerveau sont observé, semblables à ceux de la maladie d'Alzheimer. Le cerveau de rats de laboratoire exposés à une dose de mercure-vapeur équivalente à celle de quelques amalgames dentaires, présente les mêmes anomalies moléculaires que celles observées à l'autopsie de 80 % des cerveaux de patients morts après une M.A. Et la gravité de l'anomalie est bien corrélée au taux de mercure mesuré dans le cerveau80.
Un taux de mercure est mesuré plus élevé dans le cerveau des malades d'Alzheimer, et tout particulièrement dans le noyau basal de Meynert au centre de l'encéphale, là où la dégénérescence neuronale est la plus forte chez les malades81,82. Les malades ont presque toujours un taux de mercure sanguin anormalement élevé (2 à 3 fois plus élevé que pour l'échantillon témoin)83 et le taux sanguin du mercure est plus élevé chez les malades qui ont le plus de protéines β-amyloïdes se déposant dans le cerveau.
Le mercure et d'autres métaux lourds ont une affinité pour les groupements thiols, or la tubuline possède plusieurs cystéines, un acide aminé possédant une fonction soufrée thiol (indispensable à la polycondensation de cette protéine cytosolique et c'est cette polycondensation qui forme les microtubules rigides, principaux constituants du cytosquelette des neurones, nécessaire au transport axoplasmique qui nourrit le neurone. Les fonctions thiol ont une affinité très élevée pour les cations mercuriques hydrosolubles84, elles interviennent d'ailleurs dans les phénomènes naturels de détoxication des métaux lourds. In vitro, de faibles doses de mercure inorganique (Hg2+) suffisent à inhiber la production de glutathion par les neuroblastomes (cellules neuronales modifiées). Le glutathion est un tripeptide soufré normalement très présent dans le cerveau qu'il protège en tant que puissant antioxydant du milieu cellulaire. À faible dose, le mercure induit aussi (démontré expérimentalement chez le porc) une hyperphosphorylation des protéines tau et un dépôt de protéine β-amyloïde, deux caractéristiques de la MA85.
La mélatonine est une hormone essentielle, produite par la glande pinéale (ou épiphyse), synchronisant les biorythmes, mais jouant aussi un rôle antioxydant et protégeant les neurones du mercure. L'effet cytotoxique du mercure via le stress oxydatif est connu, mais des chercheurs ont montré dans les années 2000 qu'il augmente aussi la sécrétion de bêta-amyloïde et la phosphrylation des protéines Tau dans les cellules de neuroblastome SHSY5Y. Ils ajoutent que la mélatonine protège bien les neurones contre l’action oxydante des cations mercuriques86. In vitro, dans une culture de tissu cérébral humain, de très faibles doses de mercure inorganique suffisent à inhiber la phosphorylation de la tubuline par la guanosine-triphosphate (GTP), co-facteur nécessaire à la construction des microtubules, alors que d'autres métaux (même neurotoxiques connus comme le plomb, y compris sous leur forme ionisée) n'ont pas cet effet, pas plus que le fer ou le zinc ou l’aluminium, un temps suspectés87.
Le mercure inhibe la fixation des riboses sur l’adénosine diphosphate (ADP ; co-enzyme nucléotidique de la tubuline), ce qui inhibe la polycondensation de cette protéine (30), entraînant la formation d’amas neurofibrillaires cytotoxiques88. Des neurones mis en culture dégénèrent quand ils sont exposés à de très faibles doses de mercure inorganique ionisé (Hg2+) avec, dans le même temps, formation d’amas de neurofibrilles. L'Université de médecine de Calgary a produit une vidéomicroscopie qui montre qu'une dose infime de (10-7 Mol) mercure suffit à mettre à nu une gaine de microtubules, par perte des neurofibrilles qui se dépolymérisent progressivement (Voir la vidéo). Cet effet n’est pas retrouvé avec d’autres métaux neurotoxiques : aluminium, plomb, manganèse89.
Des cultures de cellules souches de neurones ont été exposées à de faibles taux de mercure inorganique : celui-ci y bloque les fonctions de la tubuline, et induit la mort des cellules, par apoptose, ainsi que la formation de protéines connues pour être chaperonnes du stress thermique90.
Des chélateurs (molécules captant les métaux) associés à des antioxydants permettent une solubilisation de la protéine β-amyloïde (PbA). C'est un indice de plus en faveur d'une responsabilité du mercure dans l'accumulation de cette protéine pathogène91. Un métabolisme anormal (homéostasie cellulaire perturbée) de deux autres cations métalliques (cuivre et zinc, nécessaires au fonctionnement du cerveau) serait également associé à l'apparition des plaques amyloïdes. Débarrasser le cerveau de ses excès de certains métaux pourrait être une piste thérapeutique contre la MA92. In vitro, le mercure interagit négativement avec le glutamate (neuromédiateur excitateur) dont il perturbe la synthèse et le transport93,94. Or le glutamate est essentiel pour le cerveau et la mémoire, mais ne doit pas être présent en excès. Dans la fente synaptique, les cations mercuriques (à dose micromolaire, 10-6 Mol), freinent la capture du glutamate par les astrocytes, en se fixant sur les fonctions thiols des transporteurs protéiques du glutamate95. Le glutamate s'accumule et devient hyperexcitant, au point de tuer les cellules nerveuses.
In vivo, le liquide cérébrospinal des M.A contient toujours un taux anormalement élevé de glutamine-synthétase (GS), ce qui peut être dû au fait que le mercure inorganique freine l’activité de la GS dans les astrocytes bien plus efficacement que le cation méthylmercure (…avec une relation dose-dépendante, et même à très faible dose puisque 5 μM de mercure inorganique durant 6 heures suffisent à diminuer de 74 % l’activité de la GS)96. Le mercure, en augmentant le taux de glutamate excitotoxique peut entrainer la lyse d'astrocytes97.
Le taux d'adénosine triphosphate (ATP) des cellules neuronales est en outre piloté par une enzyme (la créatine kinase, ou CK), qui est également vulnérable aux cations mercuriques car possédant un grand nombre de fonctions thiols. Or un taux anormalement bas de cette enzyme est constatée dans les zones du cerveau les plus affectées par la MA98,99.
L'effet toxique du mercure est aggravé chez les personnes génétiquement moins aptes à sa détoxication. Or, cette susceptibilité génétique au mercure (liée au polymorphisme du gène de l’apolipoprotéine E ou APOE) est corrélée à un risque beaucoup plus élevé de développer une MA, et de la développer plus jeune100,101. Un trouble cognitif léger a aussi plus de valeur prédictive chez ces derniers102. Ce gène APOE existe sous 3 formes (allèles APOE2, APOE3 et APO4). L'APOE 2 est plutôt protecteur, alors que l'APOE4 expose au risque maximal (y compris pour l'âge)103,104,105. Par exemple, un caucasien homozygote pour APOE2 a 25 fois moins de risques de MA que son homologue homozygote pour APOE4 (OR =0,6 vs 14,9). C'est un argument de plus en faveur de la responsabilité du mercure.
- les antécédents familiaux de maladie d'Alzheimer sont un facteur de risque.
Les personnes porteuses de trisomie 21 (syndrome de Down)106,107,108.
Il existe des mutations spécifiques (préséniline, APP)
- Gène de la clusterine109.
- Gède codant la protéinePICALM (phosphatidylinositol-binding clathrin assembly protein) contribuant au système immunitaire,
- CR1 (récepteur 1 du composant 3b/4b du complément) a aussi été ajouté fortement suspecté110.
Pronostic
La famille comprend les enfants, les frères et sœurs, nièces et neveux, etc. En se référant au nombre estimé en 2007 de 800 000 malades en France et en considérant une moyenne de 3 cellules familiales autour d'un malade, ce sont plus de 2 400 000 personnes qui sont concernées plus ou moins directement par la maladie d'Alzheimer. C'est un problème majeur de société, la progression du nombre de malades étant d'environ 250 000 cas par an [réf. incomplète] 111.
La famille a des ressources limitées en temps pour offrir à la personne malade le soutien dont elle a besoin de façon de plus en plus continue au fur et à mesure de l'évolution de la maladie. Pourtant, dans 70 % des cas, c'est la famille qui prend en charge la personne malade et lui permet de rester à domicile.
On a pris conscience de l'apport considérable de l'aidant naturel (aussi nommé aidant familial) et les professionnels se rendent compte que l'« aide aux aidants » est probablement une des manières de répondre à cet énorme défi de santé publique.
En France, 70 % des époux et 50 % des enfants d'une personne souffrant de la maladie d'Alzheimer lui consacrent plus de 6 heures par jour. 24 % des aidants – et 54 % s’il s’agit d’enfants d'une personne atteinte de la maladie d'Alzheimer – doivent réaménager leur activité professionnelle. 20 % des aidants naturels d'une personne atteinte de la maladie d'Alzheimer déclarent différer, voire renoncer à une consultation, une hospitalisation ou un soin pour eux-mêmes par manque de temps112[réf. incomplète]. Si la prévalence de la maladie continue d'augmenter, elle mobilisera à lui seul et pour le simple nursing un dixième de la population active. Par ailleurs, il semblerait que la mortalité des personnes aidant soit supérieure à celle de personnes du même âge ne s'occupant pas d'un malade, mais cela n'est pas clairement établi à ce jour113. Dans le cadre du Plan Alzheimer 2008-2012, a été mis en place un métier le Technicien-Coordinateur de l’aide psycho-sociale aux aidants en réponse aux problématiques de ses aidants.
Traitements
Aucune méthode ne protège définitivement de la maladie d’Alzheimer, mais quelques facteurs de diminution du risque sont connus ;
Conserver une activité cognitive simple pourrait diviser par 2 le risque de MA ; les personnes ayant suivi de longues études, ou ayant développé leur mémoire, courent moins de risques de souffrir de la maladie s'ils entretiennent cet acquis114 telle que lire un journal, jouer aux échecs ou aux dames, fréquenter les bibliothèques, etc. Cette diminution de risque n’est imputable qu’aux activités cognitives actuelles des personnes âgées. Celles pratiquées dans le passé n’auraient aucune influence sur le déclin cognitif lié à l’âge.
L'exercice physique tout au long de la vie pourrait prévenir le risque de maladie d'Alzheimer chez les sujets à risque (ref), peut être en diminuant le risque d'hypertension et d'accident cardiovasculaire115.
- alimentation pauvre en sel (pour limiter le risque d'hypertension 116)
- riche en vitamines C et E [réf. nécessaire]
- pauvre en cholestérol117
- « Le thé vert aurait une incidence directe sur les fonctions cérébrales, car il contribue à la préservation de ces fonctions et à la réparation des cellules endommagées »118 et réduirait le risque d'être atteint de démence et d'autres maladies neuro-dégénératives comme le Parkinson et l'Alzheimer 119.
- Une alimentation moins riche en viande ou le végétarisme : quelques études cliniques tendent à démontrer que la consommation de viande (poissons compris120) en grande quantité favoriserait le développement de la maladie d'Alzheimer 121,122,123,124,125. Il est notamment évoqué dans certaines études le rôle de la méthionine, transformé en homocystéine par le métabolisme intermédiaire. Une hyperhomocystéinémie est un facteur augmentant le risque cardiovasculaire, et semblerait jouer un rôle dans l'apparition de la maladie d'Alzheimer. Cependant il est nécessaire de rappeler que la méthionine est un acide aminé tout à fait indispensable à la vie, qui lorsqu'il est consommé dans les quantités habituelles ne pose aucun problème de santé publique.[réf. nécessaire] Selon certaines théories, la hausse du nombre de cas développant la maladie d'Alzheimer pourrait correspondre à la hausse de la consommation de viande dans le monde122 : ainsi, une recherche de l’American Society for nutrition, concernant des populations d'Amérique latine, de Chine et d'Inde, conclut que « la consommation de viande a été plus élevée chez ceux dont on a diagnostiqué une démence »126. Ce faisant, les populations indiennes pratiquant le végétarisme (depuis des générations) ont un taux d'individus touchés par la maladie d'Alzheimer qui est le plus faible enregistré de par le monde127,128.
- Café et caféine ont été proposés comme l'un des moyens d'améliorer l'état des patients129, mais avec des effets secondaires possibles.
- L'exposition à la lumière naturelle semble améliorer certains symptômes. La prise de mélatonine, associée à une luminothérapie pourrait améliorer les troubles du sommeil, en agissant comme inducteur de sommeil mais aussi comme facteur d'allongement de la durée de celui-ci130. L'exposition à la lumière naturelle diminuerait aussi chez ces malades les symptômes de dépression (-19 %), les limitations fonctionnelles au quotidien (- 53 %), la détérioration cognitive (- 5 %). Chez les malades observés, la prise de mélatonine facilitait l'endormissement. L'association lumière + mélatonine a aussi diminué les comportements agressifs (- 9 %), les phases d'agitation et de réveil nocturne. Il est donc conseillé131 « de bien éclairer les pièces en journée (… et) à l'inverse, de diminuer les sources de lumière en soirée pour que l'organisme reçoive le signal que la nuit est là ».
Les traitements médicamenteux contres les facteurs de risques cardio-vasculaires (avec leurs contraintes et leurs effets indésirables) peuvent être évités parfois par une meilleure hygiène de vie. Il sembleraient protéger du risque de maladie d'Alzheimer mais aussi des autres maladies cardiovasculaires
- Les traitements contre l'hypertension 132,133,134, et notamment les diurétiques, et surtout ceux qui agissent sur le potassium, ont été associés à un moindre risque de MA135 Ils diminuent le risque de n'importe quelle forme de démence.
Les antihypertenseurs visant l'angiotensine semblent également diminuer le risque de MA136
L'approche non-médicamenteuse est une dimension importante de la prise en charge. Des approches très diverses sont proposées. Peu ont une efficacité réellement documentée par des études scientifiques. Elles ont l'avantage de ne pas avoir d'effets indésirables.
- La rééducation / stimulation cognitive a un effet modeste, qui disparait à l'arrêt ; les thérapies occupationnelles visant à stimuler l'attention des malades ont une certaine efficacité138. Les interventions envers les aidants familiaux des patients semblent capables de retarder l'entrée en institution gériatrique, en particulier les interventions d'un type éducatif.
- Les aidants familiaux, par leur manière de se comporter, peuvent contrôler les troubles psychocomportementaux des malades. L'éducation des aidants, la notion de « base de sécurité » (un aidant choisi par le malade pour se sécuriser), de réseau d'aidants (autour de l'aidant principal), de tuteur de résilience pour l'aidantModèle:Déjargonnage, sont autant d'éléments qui font de l'aidant familial un « traitement » en soi139.
Le maintien à domicile le plus longtemps possible est souvent la solution demandé par les patients mais elle n'est pas toujours possible. La prise en charge sociale consite à trouver une solution pérenne la plus adaptée à la personne en fonction de ses souhaits et de ses capacités. Les démarches sont vouvent faites par les familles idées des médecins et de assistantes sociales.
Il n'existe actuellement aucun traitement pour guérir, ni même arrêter l'évolution, de la maladie d'Alzheimer.
- Les très nombreux médicaments anticholinergiques sont à éviter (par exemple médicaments pour l'incontinence urinaire, néfopam, certains médicaments à visée respiratoire) car ils peuvent entraîner des confusions.
- Les neuroleptiques doivent être utilisés avec précaution par un soignant expérimenté dans ses problématiques140.
- les benzodiazépines (toutes, mais surtout à demi-vie longue) sont à éviter en raison de leurs effets secondaires chez ces patients très fragiles141.
- Il faut réévaluer les médicaments d'efficacité limitée service médical rendu faible ou à visée préventive. Il existe un risque d'erreur de médicaments (à cause des troubles cognitifs) et d'effets indésirables.
- Des neuroleptiques
Ils peuvent aider pour atténuer l'angoisse, l'agressivité ou les états d'agitation des patients.
- Les antidépresseurs
Ils n'ont pas prouvé d'efficacité142. Ils peuvent cependant aider pendant une période courte à la phase initiale en temps que traitement d'épreuve (voir diagnostic différentiel)
Ils inhibent la dégradation de l'acétylcholine, une molécule permettant la transmission entre certains neurones du cerveau par l'intermédiaire de ses synapses. Ainsi, ils visent à corriger le déficit en acétylcholine observé dans le cerveau des personnes atteintes de cette maladie.
Plusieurs inhibiteurs ont été testés de façon rigoureuse) et ont prouvé une certaine efficacité, dans les formes légères à modérément sévères : le donépézil143, la rivastigmine, et la galantamine. En 2007 la Commission française de la transparence a réévalué quatre anticholinestérasiques et a conclu à une ASMR mineure144. D'après la revue Prescrire leurs effets sont modestes, de quelques mois, chez environ 10 % des patients145.
Bien que modestes, leurs effets sont significativement supérieurs à ceux du placebo : ralentissement ou retard du déclin cognitif et de la perte d'autonomie.
L'effet de ces traitements est stabilisateur et ils ne permettent pas de guérir la maladie, ni de récupérer le niveau de performances préexistant à sa survenue. Leurs utilisations exposent à de nombreuses interactions médicamenteuses, ainsi qu'à des effets indésirables.
Les anticholinestérasiques ont des effets secondaires146, surtout de type digestif (nausées et vomissement). Certains induiraient une surmortalité cardiovasculaire et des tremblements et/ou une aggravation de symptômes parkinsoniens147 ce qui a été à l'origine de controverses portant notamment sur leur justification économique148. Néanmoins, les organismes d'expertise les plus sérieux reconnaissent leur intérêt149. Les grandes agences de santé, en France, la Haute Autorité de Santé, ne recommandent plus leur utilisation dans la maladie d'Alzheimer en dehors d'un cadre très précis 150.
- Les récepteurs neuronaux au N-methyl-D-aspartate (NMDA) jouent un rôle important dans les processus de mémorisation. Il semble que lors de la maladie d'Alzheimer ces récepteurs soient hyperstimulés par le glutamate, ce qui serait délétère. Elle est réservée aux stades moyens ou avancés151.
- La vitamine D a démontré une efficacité en synergie avec la mémantine. La mémantine et la vitamine D isolément n'ont guère amélioré l'état de patients atteints de la maladie d'Alzheimer mais ont permis des améliorations cognitives significatives en six mois lorsque prises conjointement152
Recherche
Afin d'étudier l'apparition de la maladie, des souris transgéniques sont utilisées pour reproduire les symptômes observés chez l'homme. Les mutations sont donc principalement effectuées sur les gènes de la protéine tau et/ou de la protéine amyloïde. Cependant les résultats sur ces modèles animaux restent difficiles à interpréter, notamment pour l'efficacité des éventuels traitements testés et leur transfert vers l'homme[réf. nécessaire].
Les souris ayant eu une mutation sur le gène codant la protéine Tau montrent une apparition de la maladie peu prononcée et les souris ayant eu une mutation sur le gène codant la protéine amyloïde se comportent comme des souris saines. C'est seulement lorsque les deux gènes sont mutés que les souris développent une maladie semblable à celle d'Alzheimer[réf. nécessaire]. Cela ne se passe pas obligatoirement de façon identique chez l'homme, mais cela montrerait que les plaques amyloïdes potentialisent l'apparition de la maladie. Les neurofibrilles apparaissent dans un premier temps et lorsque les plaques amyloïdes apparaissent, la maladie se déclenche. Il est certain que chez l'homme, le processus pathologique se développe bien avant que les premiers signes cliniques n'apparaissent[réf. nécessaire].
Le but des recherches diagnostic est de permettre un diagnostic plus sensible et plus spécifique de la maladie d'Alzheimer que l'interrogatoire et les test neuropsychlogiques. De meilleurs test pourraient permettre peut être un diagnostic plus précoce et un traitement plus précoce pour freiner l'évolution. L’intérêt de détecter précocement la maladie d'Alzheimer pourrait permettre aux personnes atteintes de bénéficier de traitements spécifiques plus précoces. De nouveaux critères, provenant d’une combinaison entre tests de mémoire, données d'imagerie cérébrale et marqueurs biologiques, pourraient permettre de détecter la maladie d'Alzheimer à un stade précoce, dès les premiers symptômes, « avec un taux de certitude diagnostique supérieur à 90 %. » 153 [réf. incomplète]
Le projet international neuGRID est un système d'analyse des images d'imageries cérébrale. Il est financé par l'Union européenne, prévoit le développement d’une infrastructure numérique pour la recherche scientifique, fondée sur le système Grid. Il est équipé d’une interface d’utilisation facile, qui permettra aux chercheurs européens de neurosciences de faire avancer la recherche pour l’étude de la maladie d'Alzheimer et d'autres maladies neurodégénératives.
|
|
Cet article doit être wikifié (octobre 2012).
La mise en forme de son texte ne suit pas les recommandations Wikipédia (style, typographie, liens internes, liens interlangues, etc – vérifier la page de discussion où ces motifs peuvent avoir été précisés). Téléchargez le guide de syntaxe et modifiez !
|
Aucun vaccin ou médicament immunogénique n'est aujourd'hui commercialisé. Un vaccin pouvant soigner cette maladie semble envisageable d'après des études menées chez l'animal. Les premiers tests sur l'homme ont été très décevants avec des effets secondaires majeurs (décès observés sans empêcher l'évolution de la maladie d'Alzheimer).
L'idée date de 1999 ; Dale Schenk, un chercheur américain, présentait dans la revue Nature une méthode semblant guérir la maladie chez des souris. En immunisant contre le peptide A bêta des souris transgéniques qui le surexpriment, il arrivait à prévenir l'apparition de dépôts chez les animaux jeunes et à limiter et même réduire leur extension chez les individus âgés.
Un premier essai clinique de phase 1 chez l'homme conduit ensuite en Angleterre a permis l'analyse suivante : les 80 patients traités supportent bien la vaccination et le quart d'entre eux produisent bien des anticorps. Un second essai a été interrompu en raison d'effets indésirables graves (méningoencéphalites). Le suivi ultérieur des patients qui ont reçu le vaccin est plus mitigé : même si chez certains patients traités les dépôts amyloïdes intracérébraux sont moins importants, le vaccin n'a pas empêché la progression de la détérioration intellectuelle jusqu'au stade terminal154.
Un autre espoir, porté par le japonais Tohru Hasegawa155 est d'utiliser l'acide homocystéique comme cible d'un vaccin. Cet acide - chez des souris 3xTg-AD (transgéniques, modifiées de manière à mimer les symptômes de la maladie humaine) - semble en effet nécessaire à la progression de la dégénérescence typique de cette affection 156,157.
Le taux de cet acide est plus élevé dans le cerveau des souris 3xTg-AD de 4 mois que chez les souris témoins normales. Quand des souris 3xTg-AD sont soumises à une carence en vitamine B6 (ce qui augmente la quantité d'acide homocystéique dans leur cerveau, cela aggrave aussi leurs troubles mémoriels, sauf en cas d'injection d'anticorps anti-acide homocystéique. Injecter ces mêmes anticorps à des souris 3xTG-AD plus vieilles et normalement alimentées a également un effet curatif, en tous cas pour les troubles mémoriels. Les chercheurs restent prudents, car on[Qui ?] a vu dans le passé que la souris n'était pas un modèle parfait pour cette maladie. Le vaccin devrait être testé sur des singes avant tout essai clinique sur l'homme.
D'autres pistes sont en cours d'évaluation. Selon une étude158, des souris (normales, et transgéniques présentant des troubles jugés comparables à ceux induits par la maladie d'Alzheimer) exposés plusieurs mois à certaines ondes électromagnétiques (de type téléphone portable ; 918 MHz; 0,25 W/kg) améliorent leur mémoire, perdent moins de capacité cognitive en vieillissant et produisent moins de plaques amyloïdes dans leur hippocampe (-35 %) et leur cortex entorhinal (-32 %). Une température cérébrale plus élevée de 1 °C et une accélération du débit sanguin cérébral sont constatées, mais le mécanisme global n'est pas compris. Si un effet similaire était constaté chez l'Homme, une piste nouvelle de traitement, non médicamenteuse et non chirurgicale s'ouvrirait.
Épidémiologie

- Aucune donnée
- ≤ 50
- 50–70
- 70–90
- 90–110
- 110–130
- 130–150
- 150–170
- 170–190
- 190–210
- 210–230
- 230–250
- ≥ 250
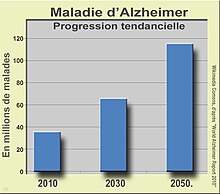

Aux États-Unis, elle a couté 94 milliards dollar à l'assurance maladie américaine en 2008160. Et elle était en 2010 dans les pays développés l'une des maladies les plus coûteuses : 604 milliards de dollars. 35,6 millions de personnes vivent avec une maladie d'Alzheimer dans le monde. Elles seront 65,7 millions en 2030 et 115,4 millions en 2050159.
Deux formes de la maladie d'Alzheimer sont diagnostiquées : la forme « familiale », plus précoce, qui a, au moins en partie, une origine génétique, et la forme dite « sporadique » qui est la forme la plus répandue de la maladie. Le risque pour cette dernière forme augmente fortement avec l'âge, ce qui en fait, à l'échelle mondiale, la troisième cause d'invalidité pour les plus de 60 ans (après les atteintes de la moelle épinière et les cancers en phase terminale13) avec une prévalence de l'ordre de 4 à 6 % à cet âge13. Ces chiffres proviennent essentiellement des études épidémiologiques effectuées dans les pays développés, en effet bien que cette maladie s'observe sur tous les continents, elle est peu caractérisée dans les pays en voie de développement où l'espérance de vie est souvent plus courte et les enquêtes épidémiologiques plus rares. La maladie d'Alzheimer est donc considérée comme une pandémie139.
À part l'âge, les autres facteurs de risque de la maladie sont mal connus et les chercheurs se tournent de plus en plus vers la recherche de causes environnementales161.
L’incidence - aux mêmes âges - est (sauf au Japon, et moindrement en Amérique centrale et du Sud) toujours plus forte dans les pays riches qu'ailleurs. Ceci est vrai pour les populations urbaines supposées plus exposées aux pollutions, mais aussi pour les populations rurales (qui par exemple en Inde développent 5,4 fois moins d'Alzheimer qu'en Pennsylvanie162). De même les Afro-Américains vivant aux États-Unis sont-ils beaucoup plus touchés que les Yorubas du Nigeria. Des chercheurs ont comparé l'incidence de Maladie d'Alzheimer (MA) dans une population Yoruba du Nigeria et chez des Afro-Américains génétiquement proches : fréquence comparable (26 à 29 %) et élevée d'allèles APOE4163, mais le risque de MA pour ces individus est deux fois moindre au Nigeria (1,15 %) qu'en Amérique du Nord (2,52 %) à âge égal, ce qui plaide aussi pour une cause environnementale, au moins dans 50 % des cas164.
Cette maladie est plus rare en Asie (alors que la population chinoise connait aussi un vieillissement important en raison de la politique de contrôle de la natalité soutenue par son gouvernement depuis les années 1960)165. Le Japon est une exception pour les pays industrialisés et riches. La prévalence de la maladie y est presque 10 fois plus faible qu'en France.
Un Japonais vivant à Hawaï ou aux États-Unis voit son niveau de risque augmenter (5,4 % pour les Japonais d’Hawaii) et se rapprocher de celui d'un Américain moyen, d'un Caucasien ou Européen165,166.). De même 5,7 % des Japonais ayant émigré au Brésil ont après quelques décennies le même risque de développer la maladie qu'un Brésilien moyen167,168.
Au Japon, l'Alzheimer est rare, mais la démence vasculaire est - comme aux États-Unis - très élevée, probablement en raison d'une consommation trop importante de sel. Cette maladie diminue au Japon grâce à la prévention et à une prise en charge plus efficace de l'hypertension169. L'exception japonaise pourrait être expliquée par le fait que, à la suite de la catastrophe de Minamata et de Niigata au Japon, le mercure a été banni de nombreux usages et notamment des amalgames dentaires. Le fait que cette maladie n'ait pas progressé au Japon, alors qu'on[Qui ?] y a aussi constaté une augmentation des caries induites par la nourriture industrielle, les sucreries et boissons gazeuses sucrées suggère que le mercure serait bien en cause, et non le sucre, ou un phénomène infectieux lié à la carie elle-même. L'espérance de vie en bonne santé y est par ailleurs parmi les meilleures au monde, ce qui n'est pas le cas en France ou en Belgique par exemple. L'espérance de vie est aussi la plus élevée au monde pour les Japonaises.
Dans le monde, le nombre de cas de malades d'Alzheimer est passé de 11 millions en 1980 à 18 millions en 2000 et 25 millions en 2004170.
En Europe, l’incidence des démences devrait croître en 50 ans de 1,9 million de nouveaux cas par an à 4,1 millions, selon les scenarii171. En Belgique, 5 à 10 % des plus de 65 ans sont touchés et près de 20 % des plus de 80 ans172. En France, l'étude « PAQUID » (1988-2001) a fait ressortir que 17,8 % des personnes de plus de 75 ans sont atteintes de la maladie d'Alzheimer ou d'un syndrome apparenté. D'après une évaluation ministérielle de 2004, environ 860 000 personnes seraient touchées par la maladie d’Alzheimer en France. Un chiffre qui pourrait atteindre 1,3 million en 2020 et 2,1 millions en 2040. Le nombre de nouveaux cas est d'environ 225 000 par an173. La prévalence des démences chez les plus de 75 ans atteint presque 18 % (maladie d’Alzheimer à 80 %)174. Ceci représente environ 900 000 malades (et dans les années 2000 environ 220 000 nouveaux cas par an), avec des tendances et projections très alarmantes : 1 200 000 malades en 2020, et plus de 2 000 000 vers 2040175.
Histoire et société
Alois Alzheimer (1864-1915) est un psychiatre et un neuropathologiste allemand du début du XXe siècle qui étudia le cerveau des personnes atteintes de démence, grâce à une nouvelle technique de coloration à l'aniline et des imprégnations argentiques.
En 1907, Alois Alzheimer décrivit pour la première fois les altérations anatomiques observées sur le cerveau d'une patiente de 51 ans, Auguste D. Atteinte de démence, elle présentait également des hallucinations visuelles et des troubles de l'orientation. En 1911, Alzheimer découvrait un cas identique à celui d'Auguste D.
C'est le psychiatre Emil Kraepelin (1856-1926) qui proposa que la maladie porte le nom d'Alzheimer, du nom de son découvreur.
L'après-baby boom (ou papy boom), la maitrise de la fécondité et le progrès médical conduisent les sociétés à devoir vivre une période où les personnes âgées seront très nombreuses. Cette maladie fait donc l'objet d'une attention particulière, notamment en France avec l'observatoire national sur la recherche sur la maladie d'Alzheimer (ONRA)176.
En 2009, la maladie d'Alzheimer explique plus de la moitié des cas de démence de la personne âgée dans les pays riches.
Voir la catégorie « Mort de la maladie d'Alzheimer »
- 2001 : Iris de Richard Eyre
- 2001 : Se souvenir des belles choses de Zabou Breitman
- 2002 : La Maladie de la mémoire de Richard Dindo
- 2004 : La Mémoire du tueur (De zaak Alzheimer) de Erik Van Looy
- 2004 : N'oublie jamais (The Notebook) de Nick Cassavetes
- 2004 : A Moment to Remember de John H. Lee
- 2005 : Une grande bouffée d'amour ! (Aiguemarine C°)
- 2005 : Black de Sanjay Leela Bhansali
- 2006 : Memories of Tomorrow de Yukihiko Tsutsumi
- 2007 : Loin d'elle (Away from Her) de Sarah Polley
- 2007 : La Brunante de Fernand Dansereau
- 2007 : (Ta mémoire… Mon Amour ! (Aiguemarine C°)
- 2008 : Cortex de Nicolas Boukhrief
- 2008 : U, Me Aur Hum de Ajay Devgan
- 2009 : Je me souviens mieux quand je peins, documentaire d'Eric Ellena et Berna Huebner
- 2009 : La Verticalidad del Tiempo, documentaire de Raùl Fernandez Rincon et Marianne Ruiz Luca Films, Madrid
- 2010 : The Secret Life of the American Teenager, Saison 1, épisode 8/23 (La Visite), série TV de Keith Truesdell
- 2010 : L'absence de Cyril de Gasperis
- 2010 : Le Monde de Barney de Richard J. Lewis
- 2011 : Je n'ai rien oublié, de Bruno Chiche, d'après le roman Small World de Martin Suter
- 2011 : La Planète des singes : Les Origines de Rupert Wyatt
- 2011 : A Thousand Days' Promise (en) ou Forget me not, œuvre coréenne de Jung Eul-young
Depuis 1997, on note une forte augmentation des œuvres comportant des personnages atteints de la maladie d'Alzheimer ou de maladie apparentée177.
- Still Alice, de Lisa Genova, Pocket Books 2007
- Alzheimer, mode d'emploi, de Jean-Pierre Polydor, L'esprit du temps 2009
- Histoire de ma mère, de Yasushi Inoué, Stock 1997, 2004 et 2007
- Je ne suis pas sortie de ma nuit, de Annie Ernaux, Gallimard 1997 et Folio 1999
- Ton chapeau au vestiaire, de Nadine Trintignant, Fayard 1997 et Pocket 1999
- Small World, de Martin Suter, Christian Bourgois 1998, et Points Seuil 2000
- Quel jour sommes-nous ? de Firmin Le Bourhis, Chiron 2000
- La Cavale du géomètre, d'Arto Paasilinna, Gallimard/folio 2000
- Elégies pour Iris, de John Bailey (en), L’Olivier 2001
- Les jours heureux, de Laurent Graff, La Dilettante 2001 et J’ai Lu 2003
- L’Effacement de l’aube, de Ronald Nossintchouk, E-Dite 2002
- Les Corrections, de Jonathan Franzen, L’Olivier 2002 et Points Seuil 2003
- Pourquoi ma mère me rend folle, de Françoise Laborde, Ramsay 2002 et J’ai Lu 2003
- Ma mère n’est pas un philodendron, de Françoise Laborde, Fayard 2003 et J’ai Lu 2005
- L’Éclipse, de Serge Rezvani, Actes Sud 2003
- Ultime amour, de Serge Rezvani, Les Belles Lettres 2012
- Mon vieux, de Thierry Jonquet, Seuil 2004
- Le Dernier qui part ferme la maison, de Michèle Fitoussi, Grasset 2004 et Poche 2006
- Les Cœurs décousus, de Jacqueline Girard-Frésard, Le Cherche Midi 2004
- Puzzle : journal d’une Alzheimer, de Claude Couturier, Josette Lyon 2004
- Les Quantités Négligeables (Le combat ordinaire, Tome 2), de Manu Larcenet, Dargaud 2004
- Sœurs, de Catherine Locandro, Gallimard 2005
- Mémorial, de Cécile Wajsbrot, Zulma 2005
- Le Piano désaccordé, de Christine Devars, Anne Carrière 2005
- Devant ma mère, de Pierre Pachet, Gallimard 2007
- Rides, de Paco Roca, Delcourt 2007
- Élégie : 1996-2006. La maladie d’Alzheimer vécue à deux, de Jean Sauvy, L’harmattan 2007
- Les Artistes de la mémoire, de Jeffrey Moore, Philippe Rey 2007
- Les Madones de Léningrad, de Debra Dean, Grasset, 2007
- La mémoire de ma mère Annie Girardot, de Giulia Salvatori, M. Lafon 2007
- Rainbows end, de Venor Vinge, Robert Laffont 2007
- On n’est pas là pour disparaître, de Olivia Rosenthal, Gallimard (Verticales) 2007
- La Vie sur terre, de Dorothée Janin, Denoël 2007
- La Plume du silence - Toi et moi…et Alzheimer, de Jean Witt, Presses de la Renaissance 2007
Notes et références
- (en) NC Berchtold et CW Cotman, « Evolution in the conceptualization of dementia and Alzheimer's disease: Greco-Roman period to the 1960s », dans Neurobiol. Aging, vol. 19, no 3, 1998, p. 173–89 [lien PMID [archive], lien DOI [archive]]
- About Alzheimer's Disease: Symptoms [archive], National Institute on Aging. Consulté le 2011-12-28
- (en) R. Brookmeyer, S. Gray et C. Kawas, « Projections of Alzheimer's disease in the United States and the public health impact of delaying disease onset », dans American Journal of Public Health, vol. 88, no 9, septembre 1998, p. 1337–42 [lien PMID [archive], lien DOI [archive]]
- http://www.caducee.net/breves/breve.asp?idb=4412&mots=all [archive]
- (en) Mölsä PK, Marttila RJ, Rinne UK, « Survival and cause of death in Alzheimer's disease and multi-infarct dementia », dans Acta Neurol Scand, vol. 74, no 2, août 1986, p. 103–7 [lien PMID [archive], lien DOI [archive]]
- (en) G Waldemar, B Dubois, M Emre, J. Georges, I. G. McKeith, M. Rossor, P. Scheltens, Tariska et B. Winblad, « Recommendations for the diagnosis and management of Alzheimer's disease and other disorders associated with dementia: EFNS guideline », dans Eur J Neurol, vol. 14, no 1, janvier 2007, p. e1–26 [lien PMID [archive], lien DOI [archive]]
- (en) Tabert MH, Liu X, Doty RL, Serby M, Zamora D, Pelton GH, Marder K, Albers MW, Stern Y, Devanand DP, « A 10-item smell identification scale related to risk for Alzheimer's disease », dans Ann. Neurol., vol. 58, no 1, 2005, p. 155–160 [lien PMID [archive], lien DOI [archive]]
- More research needed on ways to prevent Alzheimer's, panel finds [archive], National Institute on Aging, 2006-08-29. Consulté le 2008-02-29
- (en) The MetLife study of Alzheimer's disease: The caregiving experience [archive], MetLife Mature Market Institute, août 2006. Consulté le 2011-02-05
- (en) Thompson CA, Spilsbury K, Hall J, Birks Y, Barnes C, Adamson J, « Systematic review of information and support interventions for caregivers of people with dementia », dans BMC Geriatr, vol. 7, 2007, p. 18 [lien PMID [archive], lien DOI [archive]]
- (en) Schneider J, Murray J, Banerjee S, Mann A, « EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: I—Factors associated with carer burden », dans International Journal of Geriatric Psychiatry, vol. 14, no 8, août 1999, p. 651–661 [lien PMID [archive], lien DOI [archive]]
- (en) Murray J, Schneider J, Banerjee S, Mann A, « EUROCARE: a cross-national study of co-resident spouse carers for people with Alzheimer's disease: II—A qualitative analysis of the experience of caregiving », dans International Journal of Geriatric Psychiatry, vol. 14, no 8, août 1999, p. 662–667 [lien PMID [archive], lien DOI [archive]]
- (en) Cleusa P. Ferri, Martin Prince, Carol Brayne, Henry Brodaty, Laura Fratiglioni, Mary Ganguli, Kathleen Hall, Kazuo Hasegawa, Hugh Hendrie, Yueqin Huang, Anthony Jorm, Colin Mathers, Paulo R Menezes, Elizabeth Rimmer, Marcia Scazufca, « Global prevalence of dementia: a Delphi consensus study », dans Alzheimer's Disease International, The Lancet, vol. 366, no 9503, 17 décembre 2005-6 janvier 2006, p. 2112-2117 [texte intégral [archive], lien DOI [archive]]
- (en) R Brookmeyer, E Johnson, K Ziegler-Graham et HM Arrighi, « Forecasting the global burden of Alzheimer's disease », dans Alzheimer's and Dementia, vol. 3, no 3, juillet 2007, p. 186–91 [texte intégral [archive], lien DOI [archive] (pages consultées le 18 juin 2008)]
- Bonin-Guillaume S, Zekry D, Giacobini E, Gold G, Michel JP, « Impact économique de la démence », dans Presse Med, vol. 34, no 1, janvier 2005, p. 35–41 (ISSN 0755-4982) [lien PMID [archive]]
- (en) PD Meek, K McKeithan et GT Schumock, « Economic considerations in Alzheimer's disease », dans Pharmacotherapy, vol. 18, no 2 Pt 2, 1998, p. 68–73; discussion 79–82 [lien PMID [archive]]
- (en) Bäckman L, Jones S, Berger AK, Laukka EJ, Small BJ, « Multiple cognitive deficits during the transition to Alzheimer's disease », dans J Intern Med, vol. 256, no 3, septembre 2004, p. 195–204 [lien PMID [archive], lien DOI [archive]]
- (en) Nygård L, « Instrumental activities of daily living: a stepping-stone towards Alzheimer's disease diagnosis in subjects with mild cognitive impairment? », dans Acta Neurol Scand, vol. Suppl, no 179, 2003, p. 42–6 [lien PMID [archive], lien DOI [archive]]
- (en) Arnáiz E, Almkvist O, « Neuropsychological features of mild cognitive impairment and preclinical Alzheimer's disease », dans Acta Neurol. Scand., Suppl., vol. 179, 2003, p. 34–41 [lien PMID [archive], lien DOI [archive]]
- (en) Landes AM, Sperry SD, Strauss ME, Geldmacher DS, « Apathy in Alzheimer's disease », dans J Am Geriatr Soc, vol. 49, no 12, décembre 2001, p. 1700–7 [lien PMID [archive], lien DOI [archive]]
- (en) Petersen RC, « The current status of mild cognitive impairment—what do we tell our patients? », dans Nat Clin Pract Neurol, vol. 3, no 2, février 2007, p. 60–1 [lien PMID [archive], lien DOI [archive]]
- (en) Förstl H, Kurz A, « Clinical features of Alzheimer's disease », dans European Archives of Psychiatry and Clinical Neuroscience, vol. 249, no 6, 1999, p. 288–290 [lien PMID [archive], lien DOI [archive]]
- (en) Carlesimo GA, Oscar-Berman M, « Memory deficits in Alzheimer's patients: a comprehensive review », dans Neuropsychol Rev, vol. 3, no 2, juin 1992, p. 119–69 [lien PMID [archive], lien DOI [archive]]
- (en) Jelicic M, Bonebakker AE, Bonke B, « Implicit memory performance of patients with Alzheimer's disease: a brief review », dans International Psychogeriatrics, vol. 7, no 3, 1995, p. 385–392 [lien PMID [archive], lien DOI [archive]]
- (en) Taler V, Phillips NA, « Language performance in Alzheimer's disease and mild cognitive impairment: a comparative review », dans J Clin Exp Neuropsychol, vol. 30, no 5, juillet 2008, p. 501–56 [lien PMID [archive], lien DOI [archive]]
- (en) Frank EM, « Effect of Alzheimer's disease on communication function », dans J S C Med Assoc, vol. 90, no 9, septembre 1994, p. 417–23 [lien PMID [archive]]
- (en) Volicer L, Harper DG, Manning BC, Goldstein R, Satlin A, « Sundowning and circadian rhythms in Alzheimer's disease », dans Am J Psychiatry, vol. 158, no 5, mai 2001, p. 704–11 [texte intégral [archive], lien PMID [archive], lien DOI [archive] (pages consultées le 2008-08-27)]
- (en) Gold DP, Reis MF, Markiewicz D, Andres D, « When home caregiving ends: a longitudinal study of outcomes for caregivers of relatives with dementia », dans J Am Geriatr Soc, vol. 43, no 1, janvier 1995, p. 10–6 [lien PMID [archive]]
- Erreur de référence : Balise
incorrecte ; aucun texte n’a été fourni pour les références nomméespmid12934968. - (en) Desikan RS, Cabral HJ, Hess CP, et al., « Automated MRI measures identify individuals with mild cognitive impairment and Alzheimer's disease », dans Brain, vol. 132, no Pt 8, août 2009, p. 2048–57 [lien PMID [archive], lien DOI [archive]]
- Modèle:Vcite journal
- Delacourte A, David JP, Sergeant N, et al. The biochemical pathway of neurofibrillary degeneration in aging and Alzheimer's disease. Neurology 1999 ; 52 : 1158-65.
- Delacourte A, Buée L. Normal and pathological Tau proteins as factors for microtubule assembly. Int Rev Cytol 1997 ; 171 : 167-224.
- (en) Blennow K, de Leon MJ, Zetterberg H, « Alzheimer's disease », dans Lancet, vol. 368, no 9533, juillet 2006, p. 387–403 [lien PMID [archive], lien DOI [archive]]
- (en) Waring SC, Rosenberg RN, « Genome-wide association studies in Alzheimer disease », dans Arch Neurol, vol. 65, no 3, mars 2008, p. 329–34 [lien PMID [archive], lien DOI [archive]]
- (en) Selkoe DJ, « Translating cell biology into therapeutic advances in Alzheimer's disease », dans Nature, vol. 399, no 6738 Suppl, juin 1999, p. A23–31 [lien PMID [archive], lien DOI [archive]]
- (en) Shioi J, « FAD mutants unable to increase neurotoxic Aβ 42 suggest that mutation effects on neurodegeneration may be independent of effects on Abeta », dans J Neurochem., vol. 101, no 3, mai 2007, p. 674–81 [lien PMID [archive], lien DOI [archive]]
- (en) Strittmatter WJ, « Apolipoprotein E: high-avidity binding to beta-amyloid and increased frequency of type 4 allele in late-onset familial Alzheimer disease », dans Proc. Natl. Acad. Sci. USA, vol. 90, no 5, mars 1993, p. 1977–81 [lien PMID [archive], lien DOI [archive]]
- (en) Mahley RW, Weisgraber KH, Huang Y, « Apolipoprotein E4: A causative factor and therapeutic target in neuropathology, including Alzheimer's disease », dans Proc. Natl. Acad. Sci. U.S.A., vol. 103, no 15, avril 2006, p. 5644–51 [lien PMID [archive], lien DOI [archive]]
- (en) Hall K, Murrell J, Ogunniyi A, Deeg M, Baiyewu O, Gao S, Gureje O, Dickens J, Evans R, Smith-Gamble V, Unverzagt FW, Shen J, Hendrie H, « Cholesterol, APOE genotype, and Alzheimer disease: An epidemiologic study of Nigerian Yoruba », dans Neurology, vol. 66, no 2, janvier 2006, p. 223–227 [texte intégral [archive], lien PMID [archive], lien DOI [archive]]
- (en) Gureje O, Ogunniyi A, Baiyewu O, Price B, Unverzagt FW, Evans RM, Smith-Gamble V, Lane KA, Gao S, Hall KS, Hendrie HC, Murrell JR, « APOE ε4 Is Not Associated with Alzheimer's Disease in Elderly Nigerians », dans Ann Neurol, vol. 59, no 1, janvier 2006, p. 182–185 [texte intégral [archive], lien PMID [archive], lien DOI [archive]]
- [1] [archive]
- [2] [archive]
- [3] [archive]
- J.-C. Lambert et al., Genome-wide association study identifies variants at CLU and CR1 associated with Alzheimer's disease, Nature Genetics, vol. 41, p. 1094-1099, 2009. (Résumé [archive])
- D. Harold et al., Genome-wide association study identifies variants at CLU and PICALM associated with Alzheimer's disease, Nature Genetics, vol. 41, p. 1088-1093, 2009 (Résumé [archive])
- reco HAS page 2
- http://www.orpha.net/data/patho/FR/fr-alzheim.pdf [archive]
- étude épidémiologique française ayant porté sur 3 000 sujets suivis durant 14 ans H. Amieva et al. Ann Neurol. 64 492, 2008
- Novoviva.fr
- http://www.testcodex.org/Pages/articlesetreportages.aspx [archive]
- http://www.ammppu.org/abstract/geriatrie/test_horloge.htm [archive]
- http://www.esculape.com/geriatrie/alzheimer_5mots.html [archive]
- Ralph M. Reitan, « VALIDITY OF THE TRAIL MAKING TEST AS AN INDICATOR OF ORGANIC BRAIN DAMAGE », dans Perceptual and Motor Skills, vol. 8, no 3, 1958-12, p. 271-276 (ISSN 0031-5125, 1558-688X) [texte intégral [archive], lien DOI [archive] (pages consultées le 2012-10-14)]
- Kivipelto M, Helkala EL, Laakso MP, Hanninen T, Hallikainen M, Alhainen K, et al. Midlife vascular risk factors and Alzheimer’s disease in later life: longitudinal, population based study. BMJ 2001;322:1447-51 (Résumé [archive])
- Whitmer RA, Sidney S, Selby J, Johnston SC, Yaffe K. Midlife cardiovascular risk factors and risk of dementia in late life. Neurology 2005;64:277-81 (Résumé [archive])
- Luchsinger JA, Reitz C, Honig LS, Tang MX, Shea S, Mayeux R. Aggregation of vascular risk factors and risk of incident Alzheimer disease. Neurology 2005;65:545-51 (Résumé [archive])
- Newman AB, Fitzpatrick AL, Lopez O, Jackson S, Lyketsos C, Jagust W, et al. Dementia and Alzheimer’s disease incidence in relationship to cardiovascular disease in the Cardiovascular Health Study cohort. J Am Geriatr Soc 2005;53:1101-7
- Nien-Chen Li, Austin Lee, Rachel A Whitmer, Miia Kivipelto, Elizabeth Lawler, Lewis E Kazis, and Benjamin Wolozin ; Use of angiotensin receptor blockers and risk of dementia in a predominantly male population: prospective cohort analysis ; BMJ 2010;340:b5465, doi:10.1136/bmj.b5465 (2010/01/12) ; résumé [archive], publié en Creative Commons Attribution Non-commercial License, consulté 5 avril 2010)
- De la Torre JC. Is Alzheimer’s disease a neurodegenerative or a vascular disorder ? Data, dogma, and dialectics. Lancet Neurol 2004;3:184-90
- Ruitenberg A, den Heijer T, Bakker SL, van Swieten JC, Koudstaal PJ, Hofman A, et al. Cerebral hypoperfusion and clinical onset of dementia: the Rotterdam Study. Ann Neurol 2005;57:789-94
- Encinas M, De Juan R, Marcos A, Gil P, Barabash A, Fernandez C, et al. Regional cerebral blood flow assessed with 99mTc-ECD SPET as a marker of progression of mild cognitive impairment to Alzheimer’s disease. Eur J Nucl Med Mol Imaging 2003;30:1473-80.
- Use of angiotensin receptor blockers and risk of dementia in a predominantly male population: prospective cohort analysis ; BMJ 2010;340:b5465, doi:10.1136/bmj.b5465 (2010/01/12) ; résumé [archive], publié en Creative Commons Attribution Non-commercial License, consulté 5 avril 2010)
- Sjogren M, Mielke M, Gustafson D, Zandi P, Skoog I. Cholesterol and Alzheimer’s disease—is there a relation ? Mech Ageing Dev 2006;127:138-47.
- Morris MC, Evans DA, Bienias JL, Tangney CC, Bennett DA, Aggarwal N, Schneider J, Wilson RS, « Dietary fats and the risk of incident Alzheimer disease. », dans Arch Neurol., vol. 60, no (2), 2003, p. 194-200 [texte intégral [archive]]
- Rusanen M, Kivipelto M, Quesenberry Jr CP, Zhou J, Whitmer RA, Heavy smoking in midlife and long-term risk of Alzheimer disease and vascular dementia [archive], Arch Intern Med, 2011;171:333-339
- « Facteurs environnementaux impliqués dans la maladie d’Alzheimer. Le mercure dentaire, probable déterminant majeur », lire en ligne [archive] sur em-consulte.com
- M Bates et al. Health effects of dental amalgam exposure: a retrospective cohort study. Int. J. Epidemiol. (2004) 33 (4): 894-902. [4] [archive]
- J Mutter Does Inorganic Mercury Play a Role in Alzheimer’s Disease? A Systematic Review J Alzheimers Dis. 2010;22(2):357-74. [5] [archive]
- OMS (WHO/IPCS) ; 1991 : extrait de Global Mercury Assessmenr (ONU; Mercury Programm, chap 4). (OnLine [archive])
- Weiner JA, Nylander M. ; The relationship between mercury concentration in human organs and different predictor variables. Sci Total Environ. Septembre 1993 ; 0;138(1-3):101-15
- Nylander M, Friberg L, Lind B ; Mercury concentrations in the human brain and kidneys in relation to exposure from dental amalgam fillings. Swed Dent J. ; 1987 ; 11(5):179-87
- Eggleston DW, Nylander M J Prosthet ; Correlation of dental amalgam with mercury in brain tissue. Dent. ; décembre 1987 ; 58(6):704-7
- Drasch G, Schupp I, Hofl H, Reinke R, Roider G Eur ; Mercury burden of human fetal and infant tissues. ; J Pediatr. ; août 1994 ; 153(8):607-10
- Guzzi G, Grandi M, Cattaneo C, Calza S, Minoia C, Ronchi A, Gatti A, SeveriDental amalgam and mercury levels in autopsy tissues: food for thought. G. ; Am J Forensic Med Pathol. 2006 Mar;27(1):42-5
- Mutter J, Naumann J, Sadaghiani C, Schneider R, Walach H. Alzheimer disease: mercury as pathogenetic factor and apolipoprotein E as a moderator;Neuro Endocrinol Lett.Octobre 2004 ; 25(5):331-9.
- Pendergrass JC, Slevin JT, Haley BE. Duhr EF,; HgEDTA complex inhibits GTP interactions with the E-site of brain beta-tubulin. ; Toxicol Appl Pharmacol. 1993 Oct;122(2):273-80
- Jones JA, Lavallee N, Alman J, Sinclair C, Garcia RI. ; Caries incidence in patients with dementia. Geriatric Dental Program, Department of Veterans Affairs Medical Center, Bedford, MA 01730, États-Unis. Gerodontology. 1993 Dec;10(2):76-82.
- Rejnefelt I, Andersson P, Renvert S. (Département des sciences de la santé de l'Université de Kristianstad) Oral health status in individuals with dementia living in special facilities. Int J Dent Hyg. Mai 2006 ; 4(2):67-71
- Pendergrass JC, Haley BE, Vimy MJ, Winfield SA, Lorscheider FL. Mercury vapor inhalation inhibits binding of GTP to tubulin in rat brain: similarity to a molecular lesion in Alzheimer diseased brain.; Neurotoxicology. ; 1997 ;18(2):315-24
- Thompson CM, Markesbery WR, Ehmann WD, Mao YX, Vance DE Regional brain trace-element studies in Alzheimer's disease. Neurotoxicology. 1988 Spring;9(1):1-7
- Ehmann WD, Markesbery WR, Alauddin M, Hossain TI, Brubaker EH ; Brain trace elements in Alzheimer's disease ; Neurotoxicology. 1986 Spring;7(1):195-206
- Increased blood mercury levels in patients with Alzheimer's disease. Hock C, Drasch G, Golombowski S, Müller-Spahn F, Willershausen-Zönnchen B, Schwarz P, Hock U, Growdon JH, Nitsch RM. J Neural Transm. 1998;105(1):59-68
- Krauhs E, Little M, Kempf T, Hofer-Warbinek R, Ade W, Ponstingl H. ; Complete amino acid sequence of beta-tubulin from porcine brain; Proc Natl Acad Sci U S A. 1981 Jul;78(7):4156-60
- Olivieri G, Brack C, Muller-Spahn F, Stahelin HB, Herrmann M, Renard P, Brockhaus M, Hock C. Mercury induces cell cytotoxicity and oxidative stress and increases beta-amyloid secretion and tau phosphorylation in SHSY5Y neuroblastoma cells. ; J Neurochem. 2000 Jan;74(1):231-6
- Olivieri G, Brack C, Muller-Spahn F, Stahelin HB, Herrmann M, Renard P, Brockhaus M, Hock C. ; Mercury induces cell cytotoxicity and oxidative stress and increases beta-amyloid secretion and tau phosphorylation in SHSY5Y neuroblastoma cells. ; J Neurochem. 2000 Jan;74(1):231-6
- Duhr EF, Pendergrass JC, Slevin JT, Haley BE.; HgEDTA complex inhibits GTP interactions with the E-site of brain beta-tubulin.Toxicol Appl Pharmacol. 1993 Oct;122(2):273-80
- Lorscheider FL, Vimy MJ, Summers AO, Zwiers H. ; The dental amalgam mercury controversy--inorganic mercury and the CNS; genetic linkage of mercury and antibiotic resistances in intestinal bacteria.; Toxicology. 1995 Mar 31;97(1-3):19-22
- Leong CC, Syed NI, Lorscheider FL, Retrograde degeneration of neurite membrane structural integrity of nerve growth conesfollowing in vitro exposure to mercury. ;Neuroreport. 2001 Mar 26;12(4):733-7
- Cedrola S, Guzzi G, Ferrari D, Gritti A, Vescovi AL, Pendergrass JC, La Porta CA Inorganic mercury changes the fate of murine CNS stem cells. ; The FASEB Journal mai 2003 ; 17(8):869-71. Epub 2003 Mar 28
- Fonte J, Miklossy J, Atwood C, Martins R The severity of cortical Alzheimer's type changes is positively correlated with increased amyloid-beta Levels: Resolubilization of amyloid-beta with transition metal ion chelators. ;J Alzheimers Dis. Avril 2001 ; 3(2):209-219
- Bush AI. ;Metal complexing agents as therapies for Alzheimer's disease.;Neurobiol Aging. Nov-Dec 2002 ; 23(6):1031-8
- Danbolt NC ; Glutamate uptake. ;Prog Neurobiol. Septembre 2001 ; 65(1):1-105
- Brookes N. ; In vitro evidence for the role of glutamate in the CNS toxicity of mercury. ; Toxicology. 1992 Dec 4;76(3):245-56.
- Mutkus L, Aschner JL, Syversen T, Shanker G, Sonnewald U, Aschner M. Mercuric chloride inhibits the in vitro uptake of glutamate in GLAST- and GLT-1-transfected mutant CHO-K1 cells
- Allen JW, Mutkus LA, Aschner M; Mercuric chloride, but not methylmercury, inhibits glutamine synthetase activity in primary cultures of cortical astrocytes ; Brain Res. Février 2001 Feb 9;891(1-2):148-57
- Boyd E. Haley (University du Kentucky); The Relationship of the toxic effects of mercury to exacerbation of the medical condition classified as Alzheimer’s disease (2002) ; (étude accessible sur le site de l’UNEP)
- Aksenov M, Aksenova M, Butterfield DA, Markesbery WR. ;Oxidative modification of creatine kinase BB in Alzheimer's disease brain. ; J Neurochem. Juin 2000;Jun;74(6):2520-7
- David S, Shoemaker M, Haley BE. ; Abnormal properties of creatine kinase in Alzheimer's disease brain: correlation of reduced enzyme activity and active site photolabeling with aberrant cytosol-membrane partitioning ; Brain Res Mol Brain Res. Mars 1998 ; 1;54(2):276-87
- Blacker D, Haines JL, Rodes L, Terwedow H, Go RC, Harrell LE, Perry RT, Bassett SS, Chase G, Meyers D, Albert MS, Tanzi R. ApoE-4 and age at onset of Alzheimer's disease: the NIMH genetics initiative. 1: Neurology. Janvier 1997 Jan ; 48(1):139-47
- Olarte L, Schupf N, Lee JH, Tang MX, Santana V, Williamson J, Maramreddy P, Tycko B,Mayeux R.Apolipoprotein E epsilon4 and age at onset of sporadic and familial Alzheimer disease in Caribbean Hispanics. ; Arch Neurol. Novembre 2006 ; 63(11):1586-90
- Aggarwal NT, Wilson RS, Beck TL, Bienias JL, Berry-Kravis E, Bennett DA. ; The apolipoprotein E epsilon4 allele and incident Alzheimer's disease in persons with mild cognitive impairment. Neurocase. Février 2005 ; 11(1):3-7
- Huang Y. ; Apolipoprotein E and Alzheimer disease. ; Neurology. 2006 Jan 24;66(2 Suppl 1):S79-85
- Slooter AJ, Cruts M, Kalmijn S, Hofman A, Breteler MM, Van Broeckhoven C, van Duijn CM Arch Neurol ; Risk estimates of dementia by apolipoprotein E genotypes from a population-based incidence study : the Rotterdam Study. Juillet 1998 ; 55(7):964-8
- Effects of age, sex, and ethnicity on the association between apolipoprotein E genotype and Alzheimer disease. A meta-analysis. APOE and Alzheimer Disease Meta Analysis Consortium.Farrer LA, Cupples LA, Haines JL, Hyman B, Kukull WA, Mayeux R, Myers RH, Pericak-Vance MA, Risch N, van Duijn CM JAMA. Octobre 1997 ; 2-29;278(16):1349-56
- [6] [archive]
- [7] [archive]
- [8] [archive]
- J.-C. Lambert et al., Genome-wide association study identifies variants at CLU and CR1 associated with Alzheimer's disease, Nature Genetics, vol. 41, p. 1094-1099, 2009. (Résumé [archive])
- D. Harold et al., Genome-wide association study identifies variants at CLU and PICALM associated with Alzheimer's disease, Nature Genetics, vol. 41, p. 1088-1093, 2009 (Résumé [archive])
- selon le rapport du prof. Ménard
- Étude Pixel [archive]
- HAS : Maladie d'Alzheimer et maladies apparentées : suivi médical des aidants naturels [archive]
- Wilson RS, The relation of cognitive activity to risk of developing Alzheimer's disease. Neurology, 27 juin 2007
- Luchsinger JA, Reitz C, Honig LS, Tang MX, Shea S, Mayeux R. Aggregation of vascular risk factors and risk of incident Alzheimer disease. Neurology 2005;65:545-51
- Qiu C, Winblad B, Fratiglioni L. The age-dependent relation of blood pressure to cognitive function and dementia. Lancet Neurol 2005;4:487-99 (CrossRef [archive])
- Wolozin B, Kellman W, Ruosseau P, Celesia GG, Siegel G. Decreased prevalence of Alzheimer disease associated with 3-hydroxy-3-methyglutaryl coenzyme A reductase inhibitors. Arch Neurol 2000;57:1439-43.(résumé [archive])
- travaux de recherche présentés lors du 4e Symposium scientifique international sur le thé et la santé humaine, Washington D.C. ; janvier 2008
- [9] [archive] Le thé qui soigne. Art. du Journal de Montréal (2008/01/16)
- http://www.emaxhealth.com/1275/91/34818/methionine-meat-other-foods-may-increase-alzheimers-risk.html [archive]
- http://timesofindia.indiatimes.com/life-style/health-fitness/health/Too-much-of-red-meat-fish-may-cause-Alzheimers/articleshow/5347074.cms [archive]
- http://www.massacreanimal.org/fr/mefaits_proteines_animales_alzheimer.php [archive]
- http://www.peta.org/living/vegetarian-living/alzheimers.aspx [archive]
- http://www.youngindianvegetarians.co.uk/Newsletter/Issue050/Ahimsa_2007_050.pdf [archive]
- http://www.expressindia.com/latest-news/Too-much-of-red-meat-fish-garlic-yogurt-may-raise-Alzheimers-risk/555311/ [archive]
- http://www.ajcn.org/cgi/content/abstract/90/2/392?maxtoshow=&HITS=10&hits=10&RESULTFORMAT=&fulltext=omega+3+dementia+india&andorexactfulltext=and&searchid=1&FIRSTINDEX=0&sortspec=relevance&resourcetype=HWCIT [archive]
- Indian village may hold key to beating dementia [archive]
- http://healthmad.com/conditions-and-diseases/beware-of-meat-consumption [archive]
- Arendash GW, Cao C. ; Caffeine and Coffee as Therapeutics Against Alzheimer's Disease. ; J Alzheimers Dis. 2010 Feb 24 (Résumé [archive])
- Riemersma-van der Lek et coll. ; Effect of bright light and melatonin on cognitive and non cognitive function of elderly residents of group care facilities. A randomized controlled trial. Revue JAMA 2008 ; 299 : 2642-2655
- Cité dans un Article de Julie Luong intitulé Lumière et mélatonine contre la maladie d'Alzheimer [archive]( 15/10/2008)
- Kehoe PG, Wilcock GK. Is inhibition of the renin-angiotensin system a new treatment option for Alzheimer’s disease? ; Lancet Neurol 2007;6:373-8 (Web of science [archive])
- Skoog I, Lithell H, Hansson L, Elmfeldt D, Hofman A, Olofsson B, et al. Effect of baseline cognitive function and antihypertensive treatment on cognitive and cardiovascular outcomes: Study on COgnition and Prognosis in the Elderly (SCOPE). Am J Hypertens 2005;18:1052-9. (CrossRef [archive])
- Forette F, Seux ML, Staessen JA, Thijs L, Babarskiene MR, Babeanu S, et al. The prevention of dementia with antihypertensive treatment: new evidence from the Systolic Hypertension in Europe (Syst-Eur) study. Arch Intern Med 2002;162:2046-52. (Résumé [archive])
- Ara S. Khachaturian et al. ; Antihypertensive Medication Use and Incident Alzheimer Disease ; Arch Neurol. 2006;63:686-692. Published online March 13, 2006 (doi:10.1001/archneur.63.5.noc60013) (Résumé [archive])
- Matchar DB, McCrory DC, Orlando LA, Patel MR, Patel UD, Patwardhan MB, et al. Systematic review: comparative effectiveness of angiotensin-converting enzyme inhibitors and angiotensin II receptor blockers for treating essential hypertension. Ann Intern Med 2008;148:16-29.
- Jick H, Zornberg GL, Jick SS, Seshadri S, Drachman DA. Statins and the risk of dementia. Lancet 2000;356:1627-31
- (en) Community based occupational therapy for patients with dementia and their care givers: randomised controlled trial [archive], Maud J L Graff, Myrra J M Vernooij-Dassen, Marjolein Thijssen, Joost Dekker, Willibrord H L Hoefnagels, Marcel G M Olde Rikkert, BMJ, 2006;333:1196
- Polydor J-P, Alzheimer, mode d'emploi, le livre des aidants, préfacé par Madeleine Chapsal, prix Femina, L'esprit du temps Édition, 2009, (ISBN, 2847951717)
- http://www.cen-neurologie.fr/2eme-cycle/Items%20inscrits%20dans%20les%20modules%20transversaux/Confusion%20et%20d%C3%A9mence%20sujet%20%C3%A2g%C3%A9/index.phtml [archive] D. Traitement et prise en charge 1. Traitements médicamenteux b. Traitements symptomatiques des troubles comportementaux
- http://www.cen-neurologie.fr/2eme-cycle/Items%20inscrits%20dans%20les%20modules%20transversaux/Confusion%20et%20d%C3%A9mence%20sujet%20%C3%A2g%C3%A9/index.phtml [archive] D. Traitement et prise en charge 1. Traitements médicamenteux b. Traitements symptomatiques des troubles comportementaux
- Banerjee S, Hellier J, Dewey M, et al. Sertraline or mirtazapine for depression in dementia (HTA-SADD): a randomised, multicentre, double-blind, placebo-controlled trial [archive], Lancet, 2011;378:403-411
- Courtney C, Farrell D, Gray R, Hills R, Lynch L, Sellwood E, Edwards S, Hardyman W, Raftery J, Crome P, Lendon C, Shaw H, Bentham P; AD2000 Collaborative Group. Long-term donepezil treatment in 565 patients with Alzheimer's disease (AD2000): randomised double-blind trial. Lancet 2004;363:2105-15. PMID 15220031 [archive]
- Amélioration du service médical rendu
- la revue Prescrire, no 293, mars 2008
- (National Institute for Health and Clinical Excellence) : Alzheimer's disease - donepezil, galantamine, rivastigmine (review) and memantine Extrait du site di NICE [archive]
- Revue Prescrire, Numéro 278, Médicaments de la maladie d'Alzheimer : à l'origine de tremblements et d'aggravation de symptômes parkinsoniens, décembre 2006
- Revue Prescrire [archive] ; Les médicaments de la maladie d'Alzheimer, Mini dossier maj 15 février 2007
- [10] [archive] National Institute for Health and Clinical Excellence (NICE)
- http://www.has-sante.fr/portail/jcms/c_1238981/reevaluation-des-medicaments-alzheimer?xtmc=&xtcr=258&portal=c_63456 [archive]
- Areosa SA, McShane R, Sherriff F. Memantine for dementia. Cochrane Database Syst Rev 2004(4);CD003154.pub2. PMID 15495043 [archive]
- .
- [ http://www.actualites-news-environnement.com/20070710-Alzheimer-diagnostic-precoce-maladie.php [archive] D'après actualites-news-environnement.com]
- Holmes C, Boche D, Wilkinson D, et als. Long-term effects of Aβ42 immunisation in Alzheimer's disease: follow-up of a randomised, placebo-controlled phase I trial [archive], Lancet 2008;372:216-223
- le Pr Tohru Hasegawa travaille au Women's Junior College de Saga au Japon
- HASEGAWA Tohru, MIKODA Nobuyuki, KITAZAWA Masashi, LAFERLA Frank M. « Treatment of Alzheimer's Disease with Anti-Homocysteic Acid Antibody in 3xTg-AD Male Mice », PLoS ONE 5(1): e8593 - 20/01/2010 - doi:10.1371/journal.pone.0008593
- Japon numéro 528 (1/02/2010) - Ambassade de France au Japon / ADIT [archive]
- Arendash GW, Sanchez-Ramos J, Mori T, Mamcarz M, Lin X, Runfeldt M, Wang L, Zhang G, Sava V, Tan J, Cao C. ; Electromagnetic field treatment protects against and reverses cognitive impairment in Alzheimer's disease mice. ; J Alzheimers Dis. 2010 ; Jan;19(1):191-210. PMID:20061638
- World Alzheimer Report 2010 [archive]
- Nouvelles percées concernant la maladie d’Alzheimer avec des souris transgéniques [archive] ; L'écho des souris, 2011(09-03
- Kuller LH. Dementia epidemiology research: it is time to modify the focus of research. J Gerontol A Biol Sci Med Sci. 2006 Dec;61(12):1314-8
- Chandra V, Pandav R, Dodge HH, Johnston JM, Belle SH, DeKosky ST, Ganguli M.Incidence of Alzheimer's disease in a rural community in India: the Indo-US study ; Neurology. 2001 25 09 ; 57(6):985-9
- Hendrie HC, Hall KS, Ogunniyi A, Gao S ; Alzheimer's disease, genes, and environment: the value of international studies.;Can J Psychiatry. 2004 Feb;49(2):92-9
- Hendrie HC ; Lessons learned from international comparative crosscultural studies on dementia, Am J Geriatr Psychiatry, juin 2006; 14(6):480-8
- Shadlen MF, Larson EB, Yukawa M. The epidemiology of Alzheimer's disease and vascular dementia in Japanese and African-American populations: the search for etiological clues. ; Department of Medicine, Harborview Medical Center, School of Pharmacy, University of Washington, Seattle, États-Unis. Neurobiol Aging. 2000 03 21 ; (2):171-81
- Graves AB, Larson EB, Edland SD, Bowen JD, McCormick WC, McCurry SM, Rice MM, Wenzlow A, Uomoto JM. Prevalence of dementia and its subtypes in the Japanese American population of King County, Washington state. The Kame Project. Department of Epidemiology and Biostatistics, University of South Florida, Tampa, États-Unis. Am J Epidemiol. 1996 Oct 15;144(8):760-71
- Yamada T, Kadekaru H, Matsumoto S, Inada H, Tanabe M, Moriguchi EH, Moriguchi Y, Ishikawa P, Ishikawa AG, Taira K, Yamori Y. ; Prevalence of dementia in the older Japanese-Brazilian population. ; Psychiatry Clin Neurosci. 2002 Feb;56(1):71-5 (Department of Internal Medicine and Health Care, Fukuoka University, Fukuoka, Japan)
- Lopes MA, Bottino CM. ; Prevalence of dementia in several regions of the world: analysis of epidemiologic studies from 1994 to 2000 (Instituto de Psiquiatria, Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, Brasil). Arq Neuropsiquiatr. Mars 2002 ;60(1):61-9
- Fujishima M, Kiyohara Y. ; Incidence and risk factors of dementia in a defined elderly Japanese population: the Hisayama study. (Department of Medicine and Clinical Sciences, Kyushu University, japon) ; Ann N Y Acad Sci. ; novembre 2002; Nov;977:1-8
- Source : Alzheimer's Disease International
- Wancata J, Musalek M, Alexandrowicz R, Krautgartner Number of dementia sufferers in Europe between the years 2000 and 2050. M. Eur Psychiatry. 2003 Oct;18(6):306-13
- (fr) Taux de patients belges atteints de la maladie d'Alzheimer [archive] sur Le centre hospitalier chrétien (CHC) [archive]. Consulté le 14 janvier 2006
- no 2454 - Rapport sur la maladie d'Alzheimer et les maladies apparentées au nom de l'Office parlementaire d'évaluation des politiques de santé [archive] (rapporteuse : Mme Cécile Gallez)
- Ramaroson H, Helmer C, Barberger-Gateau P, Letenneur L, Dartigues JF ; Prevalence of dementia and Alzheimer's disease among subjects aged 75 years or over : Résultats mis à jour du programme PAQUID cohort] (fr) ; PAQUID. ; Unité INSERM 330, Université Victor Segalen Bordeaux II. Rev Neurol (Paris). 2003 Apr;159(4):405-11
- C, Pasquier F, Dartigues JF. Epidemiology of Alzheimer disease and related disorders Helmer Med Sci (Paris). 2006 Mar;22(3):288-96 (fr)
- [PDF](fr) Document de 140 pages sur l'observatoire national sur la recherche sur la maladie d'Alzheimer [archive], voir aussi le site de l'ONRA [archive]
- Dr Douçot-Hermelin (Revue de Gériatrie 2008;33:787
A CONSULTER QUELQUES SITES INTERNET SUR CE SUJET TRAITANT DE LA MALADIE D'ALZHEIMER :
http://fondation-recherche-alzheimer.com/category/comprendre-la-maladie/
http://www.passeportsante.net/fr/Maux/Problemes/Fiche.aspx?doc=alzheimer_pm
http://www.ampa-monaco.com/index.php?/20100517468/la_maladie/lespremierssymptomes.html
http://www.news-medical.net/health/Alzheimers-Disease-Questions-%28French%29.aspx
http://www.alzheimer.ca/fr/About-dementia/Alzheimer-s-disease/What-is-Alzheimer-s-disease
**************************************************************************************************

/https%3A%2F%2Fprofilepics.canalblog.com%2Fprofilepics%2F4%2F2%2F426588.jpg)












/image%2F0964619%2F20240506%2Fob_4f0709_image-0991366-20181104-ob-95e079-jacqu.jpg)
/https%3A%2F%2Fstorage.canalblog.com%2F75%2F17%2F505612%2F129406040.jpeg)
/https%3A%2F%2Fstorage.canalblog.com%2F09%2F46%2F497307%2F133747489_o.jpg)
/https%3A%2F%2Fstorage.canalblog.com%2F94%2F33%2F497307%2F119899087_o.jpg)