LES MEDICAMENTS QUI PEUVENT COMBATTRE EFFICACEMENT LE COVID-19 DE LA PANDEMIE DU CORONAVIRUS DANS LE MONDE
Les médicaments qui peuvent aider à combattre le "CORONAVIRUS-COVID-19" sur le marché mondiale de la médecine pharmaceutique uniquement délivrés sur prescription avec ordonnance des praticiens et sous réserve avant que l'on est mis au point un vaccin pour le vaincre ... mais pour quand ?
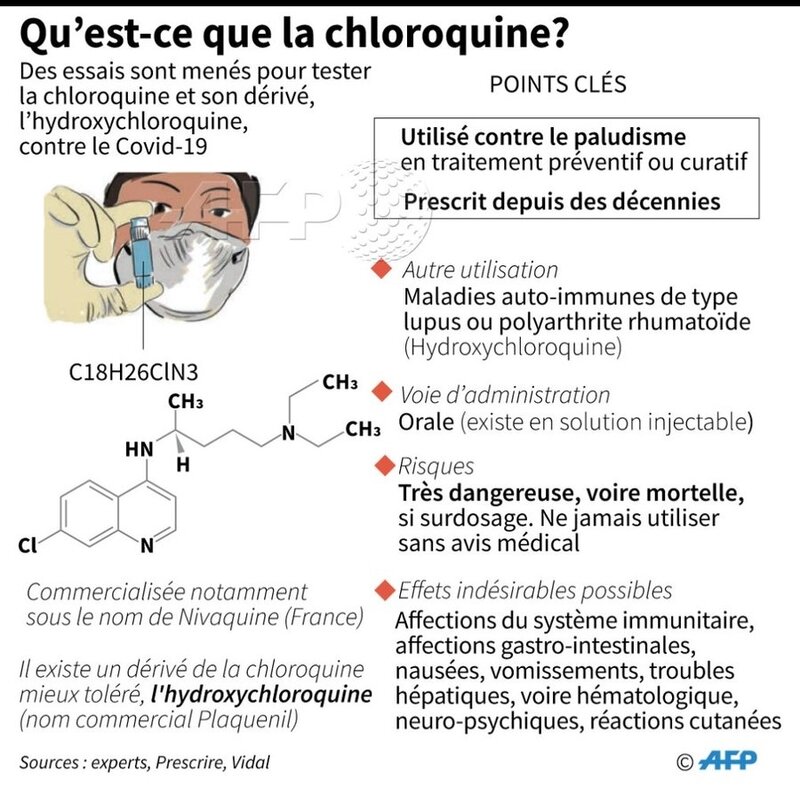
Coronavirus : le médicament cubain Interféron Alfa-2B utilisé en Chine contre l’épidémie
19 Mars 2962 Santé (3462),
Kinshasa, 19 Mars 2020 (ACP).- Le médicament cubain Interféron Alfa-2B nommé également IFNrec est utilisé en Chine pour contenir l’épidémie de Coronavirus, indique un communiqué de l’ambassade de Cuba parvenu jeudi à l’ACP.
Selon la source, l’antiviral cubain contribue à la disparition du COVID-19 dans les provinces chinoises d’Anhui, de Fujian et du Xinjiang, précisant que la Chine a fait recours aux antiviraux cubains pour lutter contre le nouveau coronavirus SRAS-nCov-2, responsable de l’épidémie de COVID-19.
Le résultat du produit cubain est très encourageant, note le document, expliquant que les provinces chinoises ayant recouru audit traitement, ont été déclarées zones blanches, c’est-à-dire avec zéro cas de contamination.
Le président cubain, Miguel Diaz-Canel, s’est félicité de l’usage de ce médicament, avant d’exprimer son soutien au gouvernement et au peuple chinois dans leurs efforts pour combattre le coronavirus, indique la source.
Interféron Alfa-2B dans le top 30 des médicaments contre le coronavirus
Le document fait savoir que l’Interféron Alfa-2b fait partie de la trentaine de produits sélectionnés par la commission nationale chinoise de la santé pour soigner le coronavirus, soulignant que sa biotechnologie est une nouvelle fois démontrée dans la lutte contre le coronavirus qui sévit en Chine.
Dans le cas du coronavirus, l’interféron Alfa-2b participe à renforcer le système immunitaire des patients en servant de mécanisme de protection, explique le communiqué. Son utilisation évite aux patients ayant des possibilités d’aggravation et de complications d’atteindre le stade qui entraînerait la mort.
Ce produit d’origine cubaine, a fait l’objet depuis quelques années d’un transfert de données dans la province de Jilin, qui a donné naissance à l’usine sino-cubaine Chang-Heber dans la ville de Changchun, explique le document, insistant sur la même technologie et sur les mêmes normes de qualité.
Ce médicament est appliqué également contre les infections virales causées par le VIH, les papillomatoses respiratoires récurrentes causées par le papillomavirus humain, le condylome acuminé et les hépatites de types B et C, en plus d’être efficace dans les thérapies contre différents types de cancer. L'île de Cuba est devenue la semaine dernière le 12eme pays latino-américain touché par l’épidémie du coronavirus qui est apparu en décembre dernier en Chine.
- Effets indésirables
- Contre-indications
- Présentation
- Composition
- Conduite de véhicules
- Précautions d’emploi
- Comment ça marche ?
- Interactions
- Surdosage
- Grossesse et allaitement
- Autres informations
***********************************************************************
Mis à jour le 09/12/2019
La Base Claude Bernard (BCB) est une base de données sur les médicaments et les produits de santé qui a pour but d'aider les professionnels de santé dans leur exercice quotidien de prescription, délivrance et dispensation et de fournir une information exhaustive au grand public.
L'équipe scientifique qui met à jour quotidiennement la BCB est exclusivement composée de professionnels de santé, médecins, pharmaciens et préparateurs en pharmacie. En savoir plus
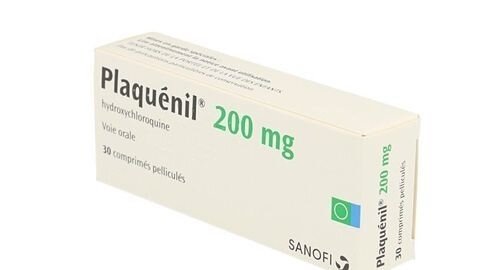
- Classes thérapeutiques: Rhumatologie
Antirhumatismaux anti-inflammatoires (voir aussi AINS) > Hydroxychloroquine - Prix de vente TTC: 4,26 €
- Taux de remboursement SS: 65 %
Partager
Dans quels cas le médicament PLAQUENIL est-il utilisé ?
- Traitement symptomatique d'action lente de la polyarthrite rhumatoïde.
- Lupus érythémateux discoïde.
- Lupus érythémateux subaigu.
- Traitement d'appoint ou prévention des rechutes des lupus systémiques.
- Prévention des lucites.
- Polyarthrite rhumatoïde
- Lupus érythémateux discoïde
- Lupus érythémateux subaigu
- Lupus systémique
- Lucite
Mode d’administration et posologie du médicament PLAQUENIL
Posologie
Réservé à l'adulte et à l'enfant à partir de 6 ans.
Traitement de la polyarthrite rhumatoïde :
- Chez l'adulte :
2 à 3 comprimés par jour en traitement d'attaque, en 2 ou 3 prises.
1 à 2 comprimés par jour en traitement d'entretien, en 1 ou 2 prises.
- Chez l'enfant :
10 à 20 mg/kg et par jour pendant une durée minimale de 6 mois.
Lupus érythémateux discoïde ou subaigu :
Initialement 1 à 2 comprimés par jour (200 à 400 mg/jour) jusqu'à disparition des lésions, pouvant être augmentée à 3 comprimés (600 mg) par jour, en cas de non-réponse après 1 à 2 mois.
La posologie est réduite progressivement, après obtention de la rémission, à 100 mg par jour pendant plusieurs mois, voire 200 à 300 mg par semaine sur plusieurs années.
Prévention des rechutes de lupus systémique :
Une posologie quotidienne en hydroxychloroquine inférieure à 7 mg/kg de poids idéal est en général suffisante.
Prévention des lucites :
2 à 3 comprimés (soit 400 à 600 mg d'hydroxychloroquine) par jour à débuter 7 jours avant le début de l'exposition solaire, puis à poursuivre pendant les 15 premiers jours.
Mode d'administration
Voie orale.
Les comprimés sont à prendre après la fin des repas.
Durée d'administration
Elle peut se prolonger pendant plusieurs mois.
Effets indésirables possible du médicament PLAQUENIL
- Modification de la cornée
- Oedème cornéen
- Dépôt cornéen
- Halos visuels
- Photophobie
- Vision floue
- Rétinopathie
- Anomalie de la pigmentation rétinienne
- Amputation du champ visuel
- Scotome à type d'anneau paracentral et péricentral
- Scotome temporal
- Vision anormale des couleurs
- Nausée
- Vomissement
- Diarrhée
- Anorexie
- Douleur abdominale
- Prurit
- Eruption cutanée
- Modification ardoisée de la pigmentation de la peau
- Modification ardoisée de la pigmentation des muqueuses
- Décoloration des cheveux
- Dermite exfoliative
- Alopécie
- Aggravation d'un psoriasis
- Eruption bulleuse
- Erythème polymorphe
- Syndrome de Stevens-Johnson
- Photosensibilité
- Pustulose exanthématique aiguë généralisée
- Neuropathie motrice
- Faiblesse neuromusculaire
- Atrophie des groupes de muscles proximaux
- Cardiomyopathie
- Bloc de branche
- Bloc auriculoventriculaire
- Hypertrophie ventriculaire
- Aplasie médullaire
- Anémie
- Anémie aplasique
- Agranulocytose
- Leuconeutropénie
- Thrombocytose
- Crise aiguë de porphyrie intermittente
- Hémolyse chez le sujet déficient en G6PD
- Acouphènes
- Vertige
- Surdité
- Céphalée
- Nervosité
- Psychose
- Convulsions
- Augmentation des transaminases
- Hépatite fulminante
- Urticaire
- Angioedème
- Bronchospasme
- Maculopathie
- Neuromyopathie
Afficher plus
La classification des évènements indésirables en fonction de leur fréquence est la suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 et < 1/10), peu fréquent (≥ 1/1000 et < 1/100), rare (≥ 1/10 000 et <1/1000), très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Effets oculaires
Fréquent :
- Une vision floue due à des troubles de l'accommodation peut survenir. Elle est dose dépendante.
Peu Fréquent :
- Des modifications au niveau de la cornée (oedème, dépôts cornéens) ont été rapportées. Soit elles sont asymptomatiques, soit elles provoquent des perturbations telles que des halos ou une photophobie. Elles sont réversibles à l'arrêt du traitement.
- Des rétinopathies avec des anomalies de la pigmentation rétinienne et du champ visuel (incluant l'amputation du champ visuel) ont été rapportées et imposent l'arrêt immédiat du traitement.
Les formes précoces des atteintes rétiniennes semblent être réversibles à l'arrêt de l'hydroxychloroquine. Ces atteintes rétiniennes peuvent être asymptomatiques au début ou peuvent se manifester par la survenue de scotomes à type d'anneau paracentral et péricentral ou des scotomes temporaux et de visions anormales des couleurs. Il existe cependant un risque de progression de cette atteinte même après l'arrêt du traitement.
Fréquence indéterminée :
- Des cas de maculopathies et de dégénérescence maculaire ont été rapportés et peuvent être irréversibles (voir rubrique Mises en garde et précautions d'emploi).
Affections gastro-intestinales
Très fréquent :
- Douleur abdominale, nausées.
Fréquent :
- Diarrhées, vomissements.
Ces symptômes disparaissent généralement dès la réduction de la dose ou à l'arrêt du traitement.
Effets cutanéo-muqueux
Fréquent :
- Prurit, éruption cutanée.
Peu fréquent :
- Modification ardoisée de la pigmentation de la peau ou des muqueuses, décoloration des cheveux, alopécie. Ces anomalies disparaissent généralement après l'arrêt du traitement.
Fréquence indéterminée :
- Eruptions bulleuses incluant l'érythème polymorphe, le syndrome de Stevens-Johnson et le syndrome de Lyell, syndrome d'hypersensibilité médicamenteuse (DRESS syndrome), photosensibilité, dermite exfoliative, pustulose exanthématique aiguë généralisée (PEAG) (voir rubrique Mises en garde et précautions d'emploi).
La PEAG est à distinguer du psoriasis, bien que PLAQUENIL puisse provoquer une aggravation de psoriasis. La PEAG peut être associée à de la fièvre et une hyperleucocytose. L'issue est généralement favorable après arrêt du traitement.
Affections musculo-squelettiques et systémiques
Fréquence indéterminée :
- Des myopathies ont été rapportées conduisant à une faiblesse progressive et à une atrophie des groupes de muscles proximaux. Ces myopathies peuvent être réversibles après l'arrêt du traitement (voir rubrique Mises en garde et précautions d'emploi).
Affections cardiaques
Fréquence indéterminée :
- Cardiomyopathie qui peut mener à une insuffisance cardiaque d'évolution fatale dans certains cas (voir rubriques Mises en garde et précautions d'emploi et Surdosage). Une toxicité chronique doit être recherchée quand des troubles de la conduction (bloc de branche / bloc auriculo-ventriculaire) ou une hypertrophie ventriculaire sont diagnostiqués (voir rubrique Mises en garde et précautions d'emploi). L'arrêt du médicament peut conduire à la guérison.
- Allongement de l'intervalle QT chez les patients à risque pouvant entraîner une arythmie (torsades de pointes, tachycardie ventriculaire) (voir rubriques Mises en garde et précautions d'emploi et Surdosage).
Affections hématologiques et du système lymphatique
Fréquence indéterminée :
- Aplasie médullaire (voir rubrique Mises en garde et précautions d'emploi), anémies, anémies aplasiques, agranulocytoses, leuconeutropénies et thrombocytopénies.
Affections de l'oreille et du labyrinthe
Peu fréquent :
- Vertiges, acouphènes.
Fréquence indéterminée :
- Surdité.
Troubles du système nerveux
Fréquent :
- Céphalées.
Fréquence indéterminée :
- Convulsions, neuropathie périphérique : diminution des réflexes ostéo-tendineux, et anomalies de la conduction nerveuse (voir rubrique Mises en garde et précautions d'emploi), troubles extrapyramidaux tels que dystonie, dyskinésie et tremblements (voir rubrique Mises en garde et précautions d'emploi).
Troubles psychiatriques
Peu fréquent :
- Nervosité.
Fréquence indéterminée :
- Psychose.
Affections hépatobiliaires
Peu fréquent :
- Anomalies des tests de la fonction hépatique.
Fréquence indéterminée :
- Hépatite fulminante.
Affections du système immunitaire
Fréquence indéterminée :
- Urticaire, angioedème et bronchospasme.
Troubles du métabolisme et de la nutrition
Fréquent :
- Anorexie.
Fréquence indéterminée :
- Hypoglycémie.
- Possibilité de crise aiguë de porphyrie chez les sujets atteints de porphyrie intermittente ou d'hémolyse aiguë chez les porteurs d'un déficit en Glucose-6-Phosphate Déshydrogénase.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Contre-indications : quand ne pas utiliser ce médicament ?
- Hypersensibilité chloroquine
- Hypersensibilité hydroxychloroquine
- Rétinopathie
- Enfant de moins de 6 ans
- Allaitement
- Intolérance au galactose
- Syndrome de malabsorption du glucose
- Syndrome de malabsorption du galactose
- Déficit en lactase
- Déficit en G6PD
- Grossesse
Afficher plus
- Hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique Composition.
- rétinopathies,
- allaitement (voir rubrique Fertilité, grossesse et allaitement),
- enfant de moins de 6 ans, en raison de la forme pharmaceutique non adaptée avant cet âge,
- en cas d'association avec le citalopram, l'escitalopram, l'hydroxyzine, la dompéridone et la pipéraquine en raison du risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe (voir rubriques Mises en garde et précautions d'emploi et Interactions avec d'autres médicaments et autres formes d'interactions).
Présentation de ce médicament
30 comprimés sous plaquettes (PVC/Aluminium).
Comprimé pelliculé.
Composition du médicament PLAQUENIL
|
Principe actif |
Comprimé pelliculé |
|
Hydroxychloroquine |
200 mg * |
* par dose unitaire
Principes actifs: Hydroxychloroquine
Excipients à effets notoires ? : Lactose monohydraté, Lactose monohydraté
Autres excipients: Povidone, Amidon de maïs, Magnésium stéarate, Pelliculage : Hypromellose, Macrogol 4000, Titane dioxyde
Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
L'attention est attirée, notamment chez les conducteurs de véhicules et les utilisateurs de machines, sur les risques de troubles de l'accommodation attachés à l'emploi de ce produit.
Mise en garde et précautions d’emploi
- Anomalie ophtalmologique
- Surveillance ophtalmologique
- Obésité
- Sujet âgé de plus de 65 ans
- Diminution de l'acuité visuelle
- Altération de la vision des couleurs
- Pustulose exanthématique généralisée
- Neuromyopathie
- Surveillance hématologique
- Anomalie hématologique
- Agranulocytose
- Aplasie médullaire
- Cardiomyopathie
- Insuffisance hépatique
- Insuffisance rénale
- Psoriasis
- Porphyrie intermittente
- Nouveau-né de mère traitée
Afficher plus
Mises en garde spéciales
Ce médicament contient du lactose. Son utilisation est déconseillée chez les patients présentant une intolérance au galactose, un déficit en lactase de Lapp ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares).
Rétinopathie
Chez les patients atteints d'affections rhumatologiques ou dermatologiques traités au long cours par des doses élevées d'hydroxychloroquine, une rétinopathie peut survenir.
Afin de dépister les complications rétiniennes liées à l'utilisation de ce médicament, qui peut exceptionnellement mener à une maculopathie irréversible, il conviendra de rechercher une anomalie ophtalmologique avant le début ou dans les premières semaines du traitement chez les patients pour lesquels un traitement au long cours est envisagé.
Cette recherche d'une anomalie ophtalmologique peut être effectuée par un questionnaire ciblé sur les troubles visuels et une évaluation de l'acuité visuelle par lecture de textes et de caractères de différentes tailles avec chaque oeil séparément.
Le caractère dose dépendant des effets indésirables oculaires ayant été établi, il conviendra de rechercher la dose minimale efficace.
En cours de traitement, les modalités et la fréquence de surveillance ophtalmologique sont à définir en fonction de :
- La dose quotidienne prescrite :
Les doses d'hydroxychloroquine inférieures à 6,5 mg/kg/j sont considérées comme les doses à faible risque chez les patients présentant un poids idéal. Les taux d'hydroxychloroquine retrouvés dans le tissu adipeux étant très faibles, le poids absolu ne devra pas être utilisé dans la détermination de la dose à administrer chez les patients obèses.
- La durée du traitement :
Aux doses inférieures à 6,5 mg/kg/j, le risque de perte permanente de l'acuité visuelle est considéré comme faible pendant les 10 premières années de traitement.
- La présence de facteurs de risque supplémentaires comme l'âge du patient supérieur à 65 ans, l'insuffisance rénale chronique, l'existence éventuelle d'une atteinte oculaire préalable.
Chez les patients avec une acuité visuelle normale, traités par des doses d'hydroxychloroquine considérées comme des doses à faible risque et sans autre facteur de risque préalable, un suivi clinique peut être effectué une fois par an (questionnaire, évaluation de l'acuité visuelle).
Chez les patients ayant une anomalie ophtalmologique préexistante ou un autre facteur de risque, un suivi ophtalmologique adapté plus rapproché peut être effectué.
Si une perturbation visuelle se produit (acuité visuelle, vision des couleurs...), le médicament devra être immédiatement interrompu et le patient suivi attentivement en raison d'une aggravation possible de l'anomalie. Des modifications rétiniennes (et des perturbations visuelles) peuvent progresser même après l'arrêt du traitement (voir rubrique Effets indésirables).
Hypoglycémie
L'hydroxychloroquine peut provoquer une hypoglycémie sévère avec perte de connaissance pouvant mettre en jeu le pronostic vital chez des patients traités ou non par des médicaments antidiabétiques (voir rubriques Interactions avec d'autres médicaments et autres formes d'interactions et Effets indésirables). Les patients traités par hydroxychloroquine doivent être informés de ce risque et des symptômes associés.
Le taux de glucose sanguin devra être contrôlé et si nécessaire le traitement sera revu devant des symptômes cliniques évocateurs d'une hypoglycémie au cours du traitement par PLAQUENIL.
Allongement de l'intervalle QTc
L'hydroxychloroquine a le potentiel d'allonger l'intervalle QTc chez certains patients à risque.
L'hydroxychloroquine doit être utilisée avec prudence chez les patients présentant un allongement de l'intervalle QT congénital ou acquis documenté et/ou des facteurs de risques connus d'allongement de l'intervalle QT tels que :
- maladie cardiaque, par exemple insuffisance cardiaque, infarctus du myocarde,
- affections pro-arythmiques, par exemple bradycardie (< 50 bpm)
- antécédents de dysrythmies ventriculaires
- hypokaliémie et/ou hypomagnésémie non corrigées
- traitement concomitant par des agents allongeant l'intervalle QT (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions)
car le risque d'arythmies ventriculaires pourrait alors être accru.
L'amplitude de l'allongement de l'intervalle QT peut augmenter avec l'augmentation des concentrations du médicament. Par conséquent, la dose recommandée ne doit pas être dépassée (voir également rubriques Effets indésirables et Surdosage).
Toxicité cardiaque chronique
Des cas de cardiomyopathie menant à une insuffisance cardiaque d'évolution fatale dans certains cas ont été rapportés chez des patients traités par PLAQUENIL (voir rubriques Effets indésirables et Surdosage). Le suivi clinique des signes et symptômes de cardiomyopathie est conseillé et PLAQUENIL doit être arrêté si une cardiomyopathie se développe. Une toxicité chronique doit être recherchée quand des troubles de la conduction (bloc de branche/bloc auriculo-ventriculaire) aussi bien que de l'hypertrophie bi ventriculaire sont diagnostiqués (voir rubrique Effets indésirables).
Risque carcinogène
Les données disponibles sur la génotoxicité de l'hydroxychloroquine sont limitées, par conséquent les données de la chloroquine ont été prises en compte en raison de la similitude de structure et des propriétés pharmacologiques des deux molécules. Les données issues de la littérature ont montré un potentiel génotoxique de la chloroquine in vitro et in vivo. Aucune étude pertinente de cancérogénicité n'a été fournie pour l'hydroxychloroquine ou la chloroquine.
Chez l'Homme, les données sont insuffisantes pour écarter un risque augmenté de cancer chez les patients recevant un traitement au long cours.
Pustulose exanthématique aiguë généralisée
La survenue en début de traitement d'un érythème généralisé fébrile associé à des pustules doit faire suspecter une pustulose exanthématique généralisée (voir rubrique Effets indésirables) ; elle impose l'arrêt du traitement et contre-indique toute nouvelle administration.
Autres surveillances pour des traitements au long cours
Les patients sous traitement au long cours doivent avoir une surveillance régulière de l'hémogramme et le traitement doit être arrêté en cas d'anomalies de celui-ci.
De rares cas d'agranulocytose, d'aplasie médullaire (nécessitant une surveillance régulière de l'hémogramme) ont été rapportés. Lors de la survenue de tels effets, le traitement par PLAQUENIL doit être arrêté immédiatement (voir rubrique Effets indésirables).
Des neuromyopathies ont été rapportées. Elles peuvent être réversibles mais la récupération peut prendre plusieurs mois. Lors de la survenue de tels effets, le traitement par PLAQUENIL doit être arrêté immédiatement (voir rubrique Effets indésirables).
Tous les patients sous traitement au long cours doivent être soumis à un examen périodique des fonctions des muscles squelettiques et des réflexes tendineux. Si une faiblesse apparaît, le traitement doit être arrêté (Voir rubrique Effets indésirables).
Des troubles extrapyramidaux peuvent survenir avec PLAQUENIL.
Précautions d'emploi
Utilisation prudente de l'hydroxychloroquine en cas d'insuffisance hépatique ou rénale (adapter la posologie), de psoriasis (aggravation des lésions).
Chez les sujets atteints de porphyrie intermittente, la prise d'hydroxychloroquine peut déclencher la survenue d'une crise aiguë.
L'hydroxychloroquine appartient à la classe des amino-4-quinoléines. D'autres médicaments de cette classe ont entraîné une hémolyse aiguë chez les sujets porteurs d'un déficit enzymatique en G6PD.
Bien qu'aucun cas d'hémolyse n'ait été rapporté avec cette substance, par principe, sa prescription chez ces personnes doit prendre en compte ce risque et le recours à une alternative thérapeutique, si elle existe, est recommandé. Si la prescription de ce médicament est nécessaire, la survenue d'une hémolyse éventuelle devra être dépistée.
Les jeunes enfants sont particulièrement sensibles aux effets toxiques des amino-4-quinoléines. Par conséquent, les patients doivent être avertis de la nécessité de garder PLAQUENIL hors de la portée des enfants.
Mécanisme d’action : comment ça marche ?
Classe pharmacothérapeutique : Autres médicaments des désordres musculo-squelettiques
(M : appareil locomoteur)
(D : dermatologie)
La substitution du groupe hydroxyéthyl au groupement éthyl sur la chaîne latérale de la 4-amino-quinoléïne lui confère une action anti-inflammatoire et antalgique.
L'effet antalgique peut apparaître rapidement. L'action sur les signes articulaires est en général retardée.
Un ralentissement de la vitesse de sédimentation peut être observé.
Interactions : ne pas prendre ce médicament avec…
Associations contre-indiquées
+ Citalopram ou escitalopram ou hydroxyzine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
+ Dompéridone
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
+ Pipéraquine
Risque majoré de troubles du rythme ventriculaire, notamment de torsades de pointe.
Associations déconseillées
+ Médicaments connus pour allonger l'intervalle QT / susceptibles d'induire une arythmie cardiaque
L'hydroxychloroquine doit être utilisée avec prudence chez les patients traités par des médicaments connus pour allonger l'intervalle QT, par exemple les anti-arythmiques de classe IA et III, les antidépresseurs tricycliques, les antipsychotiques et certains anti-infectieux, en raison du risque accru d'arythmie ventriculaire (voir rubriques Mises en garde et précautions d'emploi et Surdosage). L'halofantrine ne doit pas être administrée en association avec l'hydroxychloroquine.
Associations faisant l'objet de précautions d'emploi
+ Ciclosporine
Risque d'augmentation des concentrations sanguines de ciclosporine et de la créatininémie.
Dosage des concentrations sanguines de ciclosporine, contrôle de la fonction rénale et adaptation de la posologie pendant l'association et après l'arrêt de l'hydroxychloroquine.
+ Hormones thyroïdiennes
Risque d'hypothyroïdie clinique chez les patients substitués par hormones thyroïdiennes.
Surveillance des concentrations sériques de T3 et de T4 et adaptation, si besoin, de la posologie de l'hormone thyroïdienne pendant le traitement par l'hydroxychloroquine et après son arrêt.
+ Topiques gastro-intestinaux, antiacides et charbon
Diminution de l'absorption digestive de l'hydroxychloroquine.
Prendre les topiques gastro-intestinaux et antiacides à distance de l'hydroxychloroquine (plus de 2 heures, si possible).
Associations à prendre en compte
+ Cimétidine
Ralentissement de l'élimination de l'hydroxychloroquine et risque de surdosage.
+ Autres médicaments abaissant le seuil épileptogène
L'utilisation conjointe de médicaments proconvulsivants ou abaissant le seuil épileptogène, devra être soigneusement pesée, en raison de la sévérité du risque encouru. Ces médicaments sont représentés notamment par la plupart des antidépresseurs (imipraminiques, inhibiteurs sélectifs de la recapture de la sérotonine), les neuroleptiques (phénothiazines et butyrophénones), la méfloquine, la chloroquine, le bupropion, le tramadol.
Risque accru de convulsions.
+ Médicaments antiépileptiques
L'activité des médicaments antiépileptiques peut être altérée en cas de prise concomitante d'hydroxychloroquine.
+ Dans une étude d'interaction simple dose, il a été rapporté que la chloroquine réduit la biodisponibilité du praziquantel. Il n'existe pas de données sur un effet similaire en cas de traitement par hydroxychloroquine. Par extrapolation, en raison de similarités de structure et de paramètres pharmacocinétiques entre l'hydroxychloroquine et la chloroquine, un effet similaire peut être attendu pour PLAQUENIL.
+ Il existe un risque théorique d'inhibition de l'activité intracellulaire alpha-galactosidase quand l'hydroxychloroquine est administré concomitamment à des médicaments à base d'agalsidase.
+ Médicaments hypoglycémiants
L'utilisation d'hypoglycémiants avec l'hydroxychloroquine peut entraîner une majoration de l'effet hypoglycémiant de l'hydroxychloroquine.
Sans objet.
Comment réagir en cas de surdosage ?
Symptômes de surdosage en hydroxychloroquine :
- Doses absorbées ≥ 25mg/kg.
Céphalées, étourdissements, troubles visuels, nausées, vomissements. En cas d'intoxication grave, un élargissement du complexe QRS, des bradycardies, un rythme nodal, un allongement de l'intervalle QT, un bloc auriculo-ventriculaire, une tachycardie ventriculaire, des torsades de pointes et une fibrillation ventriculaire peuvent survenir. Certains symptômes sont de valeur pronostique très péjorative : hypotension, collapsus cardiovasculaire, signes ECG (aplatissement de l'onde T, allongement de l'espace QT, élargissement du QRS) ; un arrêt respiratoire et cardiaque peut survenir brutalement et précocement. Une hypokaliémie peut avoir lieu, probablement due à une entrée de potassium dans les cellules, augmentant ainsi le risque de dysrythmie cardiaque. L'évolution peut être fatale en cas d'insuffisance cardiaque, respiratoire ou de dysrythmie cardiaque.
Conduite à tenir :
Toute suspicion d'intoxication par l'hydroxychloroquine impose l'hospitalisation. Quelle que soit la dose supposée ingérée, toute intoxication par l'hydroxychloroquine impose une prise en charge pré-hospitalière par un service mobile d'urgence. En attendant l'ambulance, une perfusion IV avec une solution de remplissage peut être posée. En cas d'intoxication grave (dose supposée ingérée ≥ 4g ou hypotension et/ou signes ECG), le schéma thérapeutique d'urgence suivant est préconisé :
- Adrénaline : 0,25 microgramme/kg/min.
- Intubation, ventilation assistée.
- Diazépam : 2 mg/kg en 30 minutes, puis 2 à 4 mg/kg/24 heures.
L'hémodialyse ne permet pas une élimination rapide de l'hydroxychloroquine en cas d'intoxication (la clairance de dialyse représente 15% de la clairance totale). L'acidification des urines, l'hémodialyse, la dialyse péritonéale et l'exsanguinotransfusion n'apportent pas de bénéfice en cas de surdosage à l'hydroxychloroquine.
Un surdosage en amino-4-quinoléine est particulièrement dangereux chez les nourrissons. De faibles doses de 1 à 2 g se sont avérées mortelles.
PLAQUENIL: Grossesse, allaitement et fertilité
Contraception
En raison du risque génotoxique potentiel de l'hydroxychloroquine (voir rubrique Données de sécurité précliniques), par mesure de précaution, une contraception efficace est recommandée chez les hommes et les femmes en âge de procréer pendant le traitement et jusqu'à 8 mois après l'arrêt du traitement.
Grossesse
Les données non cliniques disponibles pour l'hydroxychloroquine sont limitées, par conséquent les données de la chloroquine sont prises en compte en raison de la similitude de structure et des propriétés pharmacologiques des deux molécules.
Les études chez l'animal avec la chloroquine ont montré une toxicité sur la reproduction (mort foetale et malformations oculaires) (voir rubrique Données de sécurité précliniques).
Chez l'Homme, l'hydroxychloroquine traverse le placenta, les concentrations sanguines chez le foetus sont similaires aux concentrations sanguines maternelle.
Un nombre modéré de données chez la femme enceinte (entre 300 et 1000 grossesses) n'a pas mis en évidence d'effet malformatif pour le foetus ou le nouveau-né.
Compte tenu du risque génotoxique potentiel de l'hydroxychloroquine (voir rubrique Données de sécurité précliniques), l'hydroxychloroquine ne doit pas être utilisé au cours de la grossesse à moins que la situation clinique justifie la poursuite du traitement au regard des risques potentiels encourus pour la mère et le foetus. En effet, dans certaines situations cliniques où le traitement par hydroxychloroquine permet de contrôler la pathologie et le risque de rechute, la poursuite du traitement au cours de la grossesse peut s'avérer nécessaire. Des études ont montré une réduction des poussées lupiques lors d'un traitement par hydroxychloroquine au cours de la grossesse.
En cas de traitement prolongé pendant la grossesse, tenir compte pour le suivi de l'enfant, du profil d'effets indésirables de l'hydroxychloroquine, notamment ophtalmologiques.
Allaitement
L'hydroxychloroquine passe dans le lait maternel. Compte tenu de la nature de ses effets indésirables, l'allaitement est contre-indiqué en cas de traitement par ce médicament..
Fertilité
Les études chez l'animal ont montré une altération de la fertilité masculine pour la chloroquine (voir rubrique Données de sécurité précliniques). Il n'y a pas de données pertinentes chez l'Homme pour l'hydroxychloroquine.
Autres informations
- Forme pharmaceutique: Comprimé pelliculé
- Voie d'administration: Orale
- Code ATC : M01CA
- Classe pharmacothérapeutique : Quinoléines
- Conditions de prescription et de délivrance:
Médicament non soumis à prescription médicale.
***********************************************************************
Mis à jour le 09/12/2019
La Base Claude Bernard (BCB) est une base de données sur les médicaments et les produits de santé qui a pour but d'aider les professionnels de santé dans leur exercice quotidien de prescription, délivrance et dispensation et de fournir une information exhaustive au grand public.
L'équipe scientifique qui met à jour quotidiennement la BCB est exclusivement composée de professionnels de santé, médecins, pharmaciens et préparateurs en pharmacie. En savoir plus
- Classes thérapeutiques: Infectiologie - Parasitologie
Associations d'antibactériens > Sulfaméthoxazole + Triméthoprime (Cotrimoxazole)
Antiparasitaires systémiques > Sulfaméthoxazole + Triméthoprime (Cotrimoxazole) - Taux de remboursement SS: Prise en charge selon modalités hospitalières
Partager
Dans quels cas le médicament BACTRIM est-il utilisé ?
Elles procèdent de l'activité antibactérienne et antiparasitaire du produit, des caractéristiques pharmacocinétiques du sulfaméthoxazole et du triméthoprime, du risque d'effets indésirables (hématologiques et cutanés en particulier) et doivent tenir compte, dans un pays donné, de l'évolution de la sensibilité des germes vis-à-vis du produit et des autres antibiotiques disponibles. Selon les indications et les germes en cause, il convient d'utiliser en première intention l'antibiotique présentant le meilleur rapport bénéfice/risque.
Elles sont limitées aux infections de l'adulte, de l'adolescent, de l'enfant et du nourrisson de plus de 6 semaines dues aux germes sensibles (voir rubriques Posologie et mode d'administration, Contre-indications, Mises en garde et précautions d'emploi, Effets indésirables et Propriétés pharmacodynamiques).
Tout particulièrement
·Traitement curatif :
oDes infections à Pneumocystis jirovecii ;
oDes infections uro-génitales de l'homme, notamment les prostatites.
D'autre part
En tenant compte du rapport bénéfice / risque par rapport à d'autres produits, de l'épidémiologie et des résistances bactériennes observées dans ces pathologies :
·Traitement :
oDes infections urinaires de l'enfant (voir rubrique Mises en garde et précautions d'emploi) ;
oDes infections urinaires hautes et basses de la femme (voir rubrique Mises en garde et précautions d'emploi) ;
oDes otites et sinusites, mais uniquement après documentation bactériologique (voir rubrique Mises en garde et précautions d'emploi) ;
oDe certaines infections broncho-pulmonaires ;
oDes infections digestives, et de la fièvre typhoïde ;
oDes infections neuro-méningées à Listeria monocytogenes documentées, en alternative au traitement de référence.
Il convient de tenir compte des recommandations officielles concernant l'utilisation appropriée des antibactériens
- Infection à Pneumocystis carinii
- Prostatite
- Infection urinaire
- Otite
- Sinusite
- Infection bronchopulmonaire
- Infection digestive
- Fièvre typhoïde
- Infection neuroméningée à Listeria monocytogenes
Mode d’administration et posologie du médicament BACTRIM
Posologie
Sujet normo-rénal
Adultes et adolescents de plus de 12 ans
La posologie habituelle est de 2 ampoules en perfusion toutes les 12 heures.
En cas d'infections sévères, elle peut atteindre 3 ampoules dans une perfusion le matin et 3 ampoules dans une perfusion le soir.
Cas particuliers :
Traitement des infections à Pneumocystis jirovecii : la posologie conseillée est de 100 mg/kg de sulfaméthoxazole et 20 mg/kg de triméthoprime par jour, en 3 à 4 perfusions, pendant 2 semaines.
Traitement des infections neuro-méningées à Listeria monocytogenes : 30 à 40 mg/kg/j de sulfaméthoxazole et de 6 à 8 mg/kg/j de triméthoprime.
Nourrissons de plus de 6 semaines et enfants jusqu'à 12 ans
La posologie habituelle est de 0,2 ml/kg deux fois par jour. Cette posologie correspondant à peu près à une dose quotidienne de 30 mg/kg de sulfaméthoxazole et de 6 mg/kg de triméthoprime.
A titre indicatif, 1 ml correspond à 80 mg de sulfaméthoxazole et 16 mg de triméthoprime.
Le tableau suivant donne les correspondances entre le poids corporel et la dose quotidienne (1 ml par 5 kg de poids 2 fois par jour).
|
Poids corporel |
Dose quotidienne |
|
25 kg |
5 ml matin et soir |
|
20 kg |
4 ml matin et soir |
|
15 kg |
3 ml matin et soir |
|
10 kg |
2 ml matin et soir |
|
5 kg |
1 ml matin et soir |
Sujet insuffisant rénal
Clairance de la créatinine > 30 ml/min : posologie normale, 2 perfusions journalières.
15 ml/min < clairance de la créatinine < 30 ml/min : posologie réduite de moitié, une seule perfusion journalière (voir rubrique Mises en garde et précautions d'emploi).
Clairance de la créatinine < 15 ml/min (en dehors de la dialyse) :Bactrim ne doit pas être utilisé (voir rubrique Contre-indications).
Patients dialysés :
Chez les patients hémodialysés, la posologie usuelle est réduite de moitié, administrée après dialyse, et il convient de vérifier tous les trois jours les concentrations plasmatiques de sulfaméthoxazole.
Les formes orales prendront le relais de cette forme injectable dès que l'administration per os sera possible.
Mode d'administration
La solution de triméthoprime-sulfaméthoxazole doit être diluée avant l'administration intraveineuse.
La perfusion doit être terminée, au plus tard, six heures après la dilution du triméthoprime-sulfaméthoxazole dans le soluté. Pour obtenir une concentration sanguine efficace, la perfusion, dont la durée varie en fonction du volume de la solution à perfuser, ne doit pas excéder une heure et demie. La durée habituelle est en général d'une heure.
La solution de triméthoprime-sulfaméthoxazole ne doit pas être administrée, ni par voie intraveineuse sous forme non diluée, ni par injection directe dans la tubulure (voir rubrique Instructions pour l'utilisation, la manipulation et l'élimination).
Effets indésirables possible du médicament BACTRIM
- Hyperthermie
- Oedème de Quincke
- Choc anaphylactique
- Réaction anaphylactoïde
- Pneumopathie interstitielle
- Eruption prurigineuse
- Urticaire
- Pustulose exanthématique aiguë généralisée
- Erythème polymorphe
- Syndrome de Stevens-Johnson
- Nécrose épidermique toxique
- Erythème pigmenté fixe
- Syndrome d'hypersensibilité médicamenteuse
- Purpura vasculaire
- Photosensibilité
- Nausée
- Vomissement
- Epigastralgie
- Diarrhée
- Stomatite
- Colite pseudomembraneuse
- Pancréatite
- Augmentation des transaminases
- Augmentation de la bilirubine
- Hépatite aiguë cytolytique
- Nécrose hépatique
- Hépatite cholestatique
- Hépatite mixte
- Cholestase
- Ductopénie
- Thrombopénie
- Purpura
- Leuconeutropénie
- Agranulocytose
- Aplasie médullaire
- Anémie hémolytique
- Pancytopénie
- Méthémoglobinémie
- Anémie mégaloblastique
- Cytopénie
- Vascularite
- Altération de la fonction rénale
- Néphropathie interstitielle
- Augmentation de la créatinine sérique
- Cristallurie
- Neuropathie
- Neuropathie périphérique
- Paresthésie
- Méningite aseptique
- Symptôme pseudoméningé
- Ataxie
- Convulsions
- Vertige
- Tremblement
- Uvéite
- Arthralgie
- Myalgie
- Rhabdomyolyse
- Hyperkaliémie
- Hyponatrémie
- Acidose métabolique
- Hypoglycémie
- Hallucination
- Eruption maculopapuleuse
- Anorexie
- Douleur au site d'injection
- Irritation au site d'injection
- Phlébite au site d'injection
- Réaction locale au site d'injection
Afficher plus
Les effets indésirables suivants ont été rapportés dans la population générale traitée par Bactrim.
Les catégories de fréquence utilisées sont les suivantes :
Très fréquent ≥ 1/10 ; fréquent ≥ 1/100 et < 1/10 ; peu fréquent ≥1/1000 et < 1/100 ; rare ≥ 1/10 000 et < 1/1000 ; très rare < 1/10 000 ; indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classes de systèmes d'organes |
Fréquent |
Peu fréquent |
Rare |
Très rare |
Indéterminée |
|
Affections hématologiques et du système lymphatique |
Leucopénie, Granulocytopénie, Thrombocytopénie, Anémie (mégaloblastique, hémolytique/ auto-immune, aplasique) |
Méthémoglobinémie, Agranulocytose, Pancytopénie |
|||
|
Affections cardiaques |
Myocardite allergique |
||||
|
Affections de l'oreille et du labyrinthe |
Acouphènes, Vertiges |
||||
|
Affections oculaires |
Uvéite |
Vascularite rétinienne |
|||
|
Affections gastro-intestinales |
Nausées, Vomissements |
Diarrhée, Colite pseudomembraneuse |
Glossite, Stomatite |
Pancréatite aiguë |
|
|
Troubles généraux et anomalies au site d'administration |
Douleur veineuse et phlébite |
||||
|
Affections hépatobiliaires |
Transaminases élevées |
Bilirubine élevée, Hépatite |
Cholestase |
Nécrose du foie |
Ductopénie |
|
Affections du système immunitaire |
Hypersensibilité / réactions allergiques (fièvre, angio-oedème, réactions anaphylactoïdes, maladies sériques) |
||||
|
Infections et infestations |
Infections fongiques, comme les candidoses |
||||
|
Investigations |
Hyperkaliémie, Hyponatrémie |
||||
|
Troubles du métabolisme et de la nutrition |
Hypoglycémie |
||||
|
Affections musculo-squelettiques et systémiques |
Rhabdomyolyse |
Arthralgie, Myalgie |
|||
|
Affections du système nerveux |
Convulsions |
Neuropathies (y compris neuropathie périphérique et paresthésie) |
Ataxie, Méningite aseptique/ Symptômes pseudo-méningés |
Vascularite cérébrale |
|
|
Affections psychiatriques |
Hallucinations |
||||
|
Affections rénales et des voies urinaires |
Augmentation du taux d'azote uréique sanguin, augmentation de la créatinine sérique |
Altération de la fonction rénale |
Cristallurie |
Néphropathie interstitielle, Augmentation de la diurèse |
|
|
Affections respiratoires, thoraciques et médiastinales |
Infiltrats pulmonaires |
Vascularites pulmonaires |
|||
|
Affections de la peau et du tissu sous-cutané |
Erythème pigmenté fixe, dermatite exfoliative, Rash, Rash maculopapuleux, Rash morbilliforme, Erythème, Prurit |
Urticaire |
Erythème polymorphe, Photosensibilité, Syndrome de Stevens Johnson, Syndrome de Lyell, DRESS |
||
|
Affections vasculaires |
Purpura, Purpura de Henoch-Schönlein |
Vascularite |
Des cas de décès liés à certains effets indésirables graves ont été rapportés avec Bactrim, en particulier des atteintes hématologiques (aplasie médullaire, agranulocytose, thrombopénie), des toxidermies (syndrome de Stevens-Johnson, syndrome de Lyell), syndrome d'hypersensibilité médicamenteuse (syndrome DRESS) et des atteintes hépatiques potentiellement fatales.
Description de certains effets indésirables :
Les effets indésirables rapportés, par ordre de fréquence décroissante, sont les suivants :
Troubles généraux
Des réactions d'hypersensibilité ont été rapportées :
Hyperthermie, oedème de Quincke, choc anaphylactique et réactions anaphylactoïdes. Des cas exceptionnels de pneumopathie interstitielle ont été signalés.
Affections respiratoires
La présence d'infiltrats pulmonaires rapportés dans un contexte d'alvéolite éosinophilique ou allergique peut se manifester par des symptômes tels que la toux ou l'essoufflement. (Voir rubrique Mises en garde et précautions d'emploi)
Manifestations cutanées
Comme avec tout autre médicament, des réactions allergiques telles que éruption cutanée prurigineuse et urticaire peuvent se produire chez les patients présentant une hypersensibilité aux composants du médicament. Très rares cas de pustulose exanthématique aiguë généralisée (voir rubrique Mises en garde et précautions d'emploi).
Comme d'autres médicaments contenant des sulfamides, l'association sulfaméthoxazole- triméthoprime a été associée à des manifestations cutanées de type érythème polymorphe, syndrome de Stevens-Johnson, nécrose épidermique toxique (syndrome de Lyell), érythème pigmenté fixe, syndrome d'hypersensibilité médicamenteuse (syndrome de DRESS) (voir rubrique Mises en garde et précautions d'emploi) et purpura vasculaire.
Des réactions de photosensibilité peuvent être observées avec Bactrim (voir rubrique Mises en garde et précautions d'emploi).
Troubles digestifs
Epigastralgies.
Parmi les patients atteints de pancréatite aiguë, plusieurs présentaient des maladies graves, notamment le SIDA.
Troubles hépatiques
Atteintes hépatiques aiguës cytolytiques (nécrose hépatique), cholestatiques et/ou mixtes parfois graves et rarement d'évolution fatale.
Manifestations hématologiques
Les cas de thrombopénie avec ou sans purpura, leuco-neutropénie, agranulocytose, aplasie médullaire, anémie hémolytique semblent relever préférentiellement d'un mécanisme immuno-allergique.
Chez les sujets âgés de plus de 65 ans et/ou carencés en folates, ces accidents hématologiques, en particulier les cas d'anémie mégaloblastique et de cytopénies, semblent plutôt relever d'un mécanisme toxique, dose et durée dépendant. En effet, le produit peut interférer avec le métabolisme des folates (voir rubrique Mises en garde et précautions d'emploi).
Manifestations neurologiques
De rares cas de tremblements ont été signalés.
Troubles métaboliques
L'administration de fortes doses de Bactrim, comme dans les pneumocystoses à Pneumocystis jirovecii, entraine une augmentation progressive mais réversible du potassium sérique chez un nombre substantiel de patients.
L'administration de Bactrim même aux doses recommandées peut entrainer une hyperkaliémie chez les patients présentant des troubles sous-jacents du métabolisme potassique, souffrant d'une insuffisance rénale, ou prenant des médicaments hyperkaliémiants.
Dans ces cas, l'augmentation de la kaliémie a été progressive et réversible à l'arrêt du traitement (voir rubrique Mises en garde et précautions d'emploi)
Des cas d'hyponatrémie et d'acidose métabolique ont été signalés.
Chez des patients non diabétiques, de rares cas d'hypoglycémie survenant habituellement après quelques jours de traitement ont été observés (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions). Les patients ayant une fonction rénale altérée, une maladie du foie, souffrant de malnutrition ou recevant des doses élevées de Bactrim sont particulièrement à risque.
Manifestations chez les patients atteints d'infection par le VIH / SIDA
Dans la population de patients atteints d'infection par le VIH / SIDA, les effets indésirables observés sont les mêmes que ceux observés dans la population générale. Toutefois certains effets indésirables peuvent survenir avec une fréquence supérieure et un tableau clinique différent.
Les différences de fréquence concernent les classes de systèmes d'organes suivants :
|
Classes de systèmes d'organes |
Très fréquent |
Peu fréquent |
|
Affections hématologiques et du système lymphatique |
Leucopénie, Granulocytopénie, Thrombocytopénie |
|
|
Affections gastro-intestinales |
Anorexie, nausées, vomissements, diarrhées. |
|
|
Troubles généraux et anomalies au site d'administration |
Fièvre (généralement associée à un rash maculopapuleux) |
|
|
Affections hépatobiliaires |
Transaminases élevées |
|
|
Investigations |
Hyperkaliémie |
Hyponatrémie |
|
Troubles du métabolisme et de la nutrition |
Hypoglycémie |
|
|
Affections de la peau et du tissu sous-cutané |
Rash maculopapuleux, Prurit |
Des cas de pancréatite et de rhabdomyolyse ont été rapportés chez des patients recevant par ailleurs des traitements susceptibles d'entraîner de tels effets.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet :www.signalement-sante.gouv.fr.
Contre-indications : quand ne pas utiliser ce médicament ?
- Hypersensibilité triméthoprime
- Hypersensibilité sulfamides
- Déficit en G6PD
- Atteinte sévère du parenchyme hépatique
- Allaitement si l'enfant a moins d'un mois
- Prématuré
- Nouveau-né
- Allaitement
- Exposition aux UV
- Exposition au soleil
- Anémie macrocytaire
- Porphyrie
- Grossesse premier trimestre
Afficher plus
Ce médicament NE DOIT JAMAIS ETRE UTILISE :
·Chez les prématurés et les nourrissons de moins de 6 semaines en raison de l'immaturité de leurs systèmes enzymatiques,
·En cas d'antécédents d'hypersensibilité à l'un des composants (en particulier, hypersensibilité aux sulfamides),
·En cas de déficit en G6PD, y compris chez l'enfant allaité : risque de déclenchement d'hémolyse,
·En cas d'association avec le méthotrexate (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions),
·En cas d'atteinte sévère du parenchyme hépatique,
·En cas d'insuffisance rénale sévère caractérisée par une clairance de la créatinine < 15mL/min, en dehors de la dialyse (voir rubrique Posologie et mode d'administration).
Ce médicament NE DOIT GENERALEMENT PAS ETRE UTILISE :
·En période d'allaitement (voir rubrique Fertilité, grossesse et allaitement),
·En association avec la phénytoïne, les hyperkaliémiants (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Présentation de ce médicament
Ampoule en verre de 5 ml ; boîte de 6.
Solution injectable pour perfusion.
Composition du médicament BACTRIM
|
Principe actif |
Solution injectable pour perfusion IV |
|
Sulfaméthoxazole |
0.4 g * |
|
Triméthoprime |
0.08 g * |
* par dose unitaire
Principes actifs: Sulfaméthoxazole , Triméthoprime
Excipients à effets notoires ? : Sodium métabisulfite, Ethanol
Autres excipients: Sodium hydroxyde, Diolamine, Benzylique alcool, Propylène glycol, Eau pour préparations injectables
Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Sans objet.
Mise en garde et précautions d’emploi
- Réservé à l'adulte
- Manifestation cutanée
- Perturbation hématologique
- Pustulose exanthématique aiguë généralisée
- Sujet âgé
- Carence en folates
- Grossesse à partir du 2ème trimestre
- Alcoolisme
- Insuffisance hépatique
- Dénutrition
- Malabsorption chronique
- Antécédent hématologique
- Insuffisance rénale
- Infecté par le VIH
- Epilepsie
- Régime hyposodé
- Régime désodé
Afficher plus
Limites du cadre d'utilisation de cette spécialité
Le bénéfice d'un traitement par l'association triméthoprime-sulfaméthoxazole, en particulier pour des infections peu sévères, doit être contrebalancé avec les informations relatives au profil de risque de cet antibiotique et aux données épidémiologiques. En effet la gravité éventuelle des accidents doit faire pondérer le bénéfice thérapeutique attendu par le risque encouru. Des cas de décès liés à certains effets indésirables graves ont été rapportés avec Bactrim, en particulier des atteintes hématologiques (aplasie médullaire, agranulocytose, thrombopénie), des toxidermies (syndrome de Stevens-Johnson, syndrome de Lyell, syndrome d'hypersensibilité médicamenteuse (syndrome DRESS) et des atteintes hépatiques potentiellement fatales.
Il convient de tenir compte des recommandations thérapeutiques qui peuvent limiter l'usage de cet antibiotique notamment dans le traitement d'infections urinaires et d'infections ORL.
Mises en garde spéciales
Les manifestations cutanées ou hématologiques imposent l'arrêt immédiat et définitif du traitement.
La survenue, en début de traitement, d'un érythème généralisé fébrile associé à des pustules, doit faire suspecter une pustulose exanthématique aiguë généralisée (rubrique Effets indésirables) ; elle impose l'arrêt du traitement et contre-indique toute nouvelle administration de triméthoprime seul ou associé.
Les accidents hématologiques sont plus fréquents :
·Chez les sujets âgés,
·Chez les sujets ayant une carence préexistante en folates (sujet âgé, grossesse, alcoolisme, insuffisance hépatique chronique, dénutrition, malabsorption chronique et patients traités par antiépileptiques inducteurs enzymatiques et autres médicaments inducteurs tels les médicaments de la famille de la rifampicine). Ces modifications hématologiques sont réversibles après traitement par acide folinique.
Chez ces patients, il est recommandé de ne pas dépasser dix jours de traitement par l'association triméthoprime-sulfaméthoxazole.
Un contrôle hématologique périodique est nécessaire en cas de :
·Traitement prolongé ou itératif ;
·Sujets de plus de 65 ans ;
·Sujets carencés en folates.
L'utilisation de l'association triméthoprime-sulfaméthoxazole n'est pas recommandée en cas d'anémie macrocytaire.
Des cas de pancytopénie ont été rapportés chez des patients ayant pris de façon concomitante l'association triméthoprime-sulfaméthoxazole et méthotrexate (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Chez les patients atteints de porphyrie, Bactrim est fortement déconseillé. Il ne doit être utilisé que lorsque le bénéfice l'emporte sur le risque.
La présence d'infiltrats pulmonaires rapportés dans un contexte d'alvéolite éosinophilique ou allergique peut se manifester par des symptômes tels que la toux ou l'essoufflement.Si ces symptômes apparaissent ou s'aggravent de façon inattendue, le patient doit être réévalué et l'arrêt du traitement par Bactrim doit être envisagé.
Effets rénaux
Les sulfamides, dont Bactrim, peuvent augmenter la diurèse, en particulier chez les patients souffrant d'un oedème d'origine cardiaque.
Populations particulières
Chez les patients ayant une insuffisance rénale sévère (c'est-à-dire avec une clairance de la créatinine de 15-30 mL/min) et recevant Bactrim, une surveillance est recommandée.
Précautions d'emploi
En cas d'insuffisance rénale sévère (clairance de la créatinine < 30 ml/min), la posologie doit être réduite (voir rubrique Posologie et mode d'administration).
Une surveillance biologique particulière doit être effectuée en cas d'insuffisance hépatique (transaminases et bilirubine), d'antécédents hématologiques (hémogramme, plaquettes, réticulocytes), et d'insuffisance rénale (clairance de la créatinine).
Une surveillance étroite de la kaliémie et de la fonction rénale est nécessaire chez les patients recevant une dose élevée de Bactrim, comme dans le cadre d'une pneumonie à Pneumocystis jirovecii, ainsi que chez les patients recevant une dose standard de Bactrim et présentant des troubles sous-jacents du métabolisme potassique ou une insuffisance rénale, et chez les patients infectés par le VIH , les sujets âgés, et les patients recevant d'autres médicaments hyperkaliémiants (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Pendant le traitement, assurer un apport hydrique suffisant (au moins 2 litres par jour) afin de prévenir d'éventuelles cristalluries.
Les patients devront être informés du risque de réactions de photosensibilité (voir rubrique Effets indésirables). L'exposition au soleil ou aux rayonnements UV devra être évitée et le port de vêtement pour se protéger de toute exposition directe importante au soleil est recommandé pendant toute la durée du traitement et jusqu'à trois jours suivant l'arrêt.
Ce médicament contient 12,7 % de vol d'éthanol (alcool), c'est-à-dire jusqu'à 500 mg par ampoule, ce qui équivaut à 25,4 ml de bière, 10,6 ml de vin par ampoule, soit 76,2 ml de bière ou 31,8 ml de vin par dose maximale journalière de 3 ampoules par jour. L'utilisation de ce médicament est dangereuse chez les sujets alcooliques et doit être prise en compte chez les femmes enceintes ou allaitant, les enfants et les groupes à haut risque tels que les insuffisants hépatiques ou les épileptiques.
Ce médicament contient environ 34 mg de sodium par ampoule, ce qui équivaut à 1,7 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
Ce médicament contient 2 050 mg de propylène glycol par ampoule de 5 ml. Des effets indésirables divers, parfois graves, ont été rapportés avec des doses élevées ou une utilisation prolongée de propylène glycol. Ces effets indésirables sont généralement réversibles après arrêt du propylène glycol, et dans des cas plus sévères après hémodialyse. Le propylène glycol peut être toxique chez les enfants âgés de moins de 5 ans en particulier lorsqu'il est administré en même temps qu'un substrat de l'alcool déhydrogénase tel que l'éthanol. Lors d'une administration de propylène glycol, les patients présentant une insuffisance rénale ou hépatique doivent faire l'objet d'une surveillance renforcée
Interférences biologiques (examens paracliniques)
Le triméthoprime peut interférer avec le dosage de la créatinine plasmatique quand la réaction à l'acide picrique est utilisée. Il en résulte une surestimation de l'ordre de 10 %.
L'association triméthoprime-sulfaméthoxazole, et plus spécifiquement le triméthoprime, peut interférer avec le dosage du méthotrexate qui utilise la méthode compétitive de liaison protéique, lorsque la dihydrofolate réductase bactérienne est utilisée comme protéine de liaison. Cependant, il n'y a pas d'interférence si le méthotrexate est dosé par une méthode radio-immunologique (voir rubrique Interactions avec d'autres médicaments et autres formes d'interactions).
Mécanisme d’action : comment ça marche ?
Classe pharmacothérapeutique : ASSOCIATION DE SULFAMIDE ET TRIMETHOPRIME, code ATC : J01EE01.
Ce médicament est une association d'un sulfamide, le sulfaméthoxazole, à une diaminopyrimidine, le triméthoprime, dans la proportion de 5/1.
Le sulfaméthoxazole et le triméthoprime agissent en synergie dans les proportions incluses entre : 100/1 et 10/1.
SPECTRE D'ACTIVITE ANTIBACTERIENNE
Les concentrations critiques séparent les souches sensibles des souches de sensibilité intermédiaire et ces dernières, des résistantes :
Triméthoprime - sulfaméthoxazole : S £ 2 mg/l et R > 8 mg/l
La prévalence de la résistance acquise peut varier en fonction de la géographie et du temps pour certaines espèces. Il est donc utile de disposer d'informations sur la prévalence de la résistance locale, surtout pour le traitement d'infections sévères. Ces données ne peuvent apporter qu'une orientation sur les probabilités de la sensibilité d'une souche bactérienne à cet antibiotique.
Lorsque la variabilité de la prévalence de la résistance en France est connue pour une espèce bactérienne, elle est indiquée dans le tableau ci-dessous :
|
Catégories |
Fréquence de résistance acquise en France (> 10%) (valeurs extrêmes) |
|
ESPÈCES SENSIBLES |
|
|
Aérobies à Gram positif |
|
|
Corynébactéries |
|
|
Entérocoques |
|
|
Listeria |
|
|
Staphylococcus aureus |
|
|
Staphylococcus à coagulase négative |
5 - 40 % |
|
Streptococcus |
5 - 20 % |
|
Streptococcus pneumoniae |
10 - 50 % |
|
Aérobies à Gram négatif |
|
|
Citrobacter freundii |
10 - 40 % |
|
Enterobacter |
10 - 40 % |
|
Escherichia coli |
5 - 30 % |
|
Haemophilus |
5 - 15 % |
|
Klebsiella |
10 - 40 % |
|
Morganella |
10 - 20 % |
|
Pasteurella |
|
|
Proteus |
20 - 40 % |
|
Salmonella |
|
|
Shigella |
|
|
Anaérobies |
|
|
Peptostreptococcus |
|
|
Autres |
|
|
Mycobacterium (sauf tuberculosis, avium, intracellulare) |
|
|
Borrelia |
|
|
Isospora belli |
|
|
Pneumocystis carinii |
|
|
Spirochètes |
|
|
Toxoplasma |
|
|
ESPÈCES RÉSISTANTES |
|
|
Aérobies à Gram positif |
|
|
Mycobacterium avium intracellulare |
|
|
Mycobacterium tuberculosis |
|
|
Pseudomonas |
L'association sulfamides-triméthoprime présente un effet fortement synergique vis à vis de la plupart des bactéries, y compris les souches résistantes à l'un des deux produits. Ceci explique l'activité de l'association sur les Nocardia et les Stenotrophomonas mais aussi sur Escherichia coli ayant une résistance acquise aux sulfamides (résistance même de haut niveau).
Cette synergie est maximale dans le rapport de leur CMI, c'est à dire 1/20 triméthoprime-sulfamide pour les entérobactéries et staphylocoques. En revanche, vis à vis des bactéries naturellement résistantes au triméthoprime (Nocardia, Stenotrophomonas, Neisseria) le rapport optimal doit être de 1/1 ou 2/1 triméthoprime-sulfamide.
Interactions : ne pas prendre ce médicament avec…
Interactions propres au triméthoprime
+ Médicaments hyperkaliémiants
Certains médicaments ou classes thérapeutiques sont susceptibles de favoriser la survenue d'une hyperkaliémie : les sels de potassium, les diurétiques hyperkaliémiants, les inhibiteurs de l'enzyme de conversion, les antagonistes de l'angiotensine II, les anti-inflammatoires non stéroïdiens, les héparines (de bas poids moléculaire ou non fractionnées), les immunosuppresseurs comme la ciclosporine ou le tacrolimus, le triméthoprime.
L'association de ces médicaments majore le risque d'hyperkaliémie. Ce risque est particulièrement important avec les diurétiques épargneurs de potassium, notamment lorsqu'ils sont associés entre eux ou avec des sels de potassium, tandis que l'association d'un IEC et d'un AINS, par exemple, est à moindre risque dès l'instant que sont mises en oeuvre les précautions recommandées.
Pour connaître les risques et les niveaux de contrainte spécifiques aux médicaments hyperkaliémiants, il convient de se reporter aux interactions propres à chaque substance.
Toutefois, certaines substances, comme le triméthoprime, ne font pas l'objet d'interactions spécifiques au regard de ce risque. Néanmoins, ils peuvent agir comme facteurs favorisants lorsqu'ils sont associés à d'autres médicaments déjà mentionnés dans ce paragraphe.
Associations contre-indiquées (voir rubrique Contre-indications)
+ Méthotrexate
Augmentation des effets et de la toxicité hématologique du méthotrexate par déplacement de sa liaison aux protéines plasmatiques et diminution de son excrétion rénale ainsi que par l'inhibition additive de la dihydrofolate réductase.
Association déconseillée (voir rubrique Mises en garde et précautions d'emploi)
+ Répaglinide
Risque d'augmentation des concentrations plasmatiques du répaglinide par inhibition de son métabolisme hépatique par le triméthoprime. Si l'association ne peut être évitée, surveillance clinique et biologique étroite.
Associations faisant l'objet d'une précaution d'emploi
+ Metformine
Augmentation des concentrations de la metformine par le triméthoprime. Surveillance clinique et biologique notamment chez les patients insuffisants rénaux.
+ Paclitaxel
Risque d'augmentation des concentrations plasmatiques du paclitaxel par inhibition de son métabolisme hépatique par le triméthoprime. Surveillance clinique et biologique étroite et, éventuellement, adaptation de la posologie du paclitaxel pendant l'association.
+ Pyriméthamine
Anémie mégaloblastique plus particulièrement à fortes doses des deux produits (déficit en acide folique par l'association de deux 2-4 diaminopyrimidines). Contrôle régulier de l'hémogramme et association d'un traitement par l'acide folique (injections IM régulières).
Associations à prendre en compte
+ Autres hyperkaliémiants
Risque de majoration de l'hyperkaliémie, potentiellement létale.
+ Ciclosporine
Avec le triméthoprime (seul ou associé) par voie IV : la diminution des concentrations sanguines de ciclosporine peut être très importante avec disparition possible du pouvoir immunosuppresseur.
Interactions propres au sulfaméthoxazole
Associations déconseillées (voir rubrique Mises en garde et précautions d'emploi)
+ Antivitamines K (acénocoumarol, fluindione, warfarine)
Augmentation importante de l'effet de l'antivitamine K et du risque hémorragique.
Si l'association ne peut être évitée, contrôle plus fréquent de l'INR et adaptation de la posologie de l'antivitamine K pendant le traitement par cotrimoxazole et après son arrêt.
+ Phénytoïne (et par extrapolation fosphénytoïne)
Augmentation des concentrations plasmatiques de phénytoïne jusqu'à des valeurs toxiques (inhibition de son métabolisme). Utiliser de préférence une autre classe d'anti-infectieux, sinon surveillance clinique étroite, dosage des concentrations de phénytoïne et adaptation éventuelle de sa posologie pendant le traitement par les sulfamides anti-infectieux et après son arrêt.
Association à prendre en compte
+ Autres médicaments méthémoglobinisants
Risque d'addition des effets méthémoglobinisants.
Interactions communes au sulfamethoxazole et triméthoprime
Association déconseillée
+ Substances susceptibles de donner des torsades de pointes
Risque de troubles ventriculaires, notamment de torsades de pointes.
Si l'association ne peut être évitée, contrôles cliniques et électrocardiographiques réguliers.
Association à prendre en compte
+ Sulfamides hypoglycémiants
Rares survenues d'hypoglycémies, notamment chez le sujet âgé, dénutri ou insuffisant rénal.
Problèmes particuliers du déséquilibre de l'INR
De nombreux cas d'augmentation de l'activité des anticoagulants oraux ont été rapportés chez des patients recevant des antibiotiques. Le contexte infectieux ou inflammatoire marqué, l'âge et l'état général du patient apparaissent comme des facteurs de risque. Dans ces circonstances, il apparaît difficile de faire la part entre la pathologie infectieuse et son traitement dans la survenue du déséquilibre de l'INR. Cependant, certaines classes d'antibiotiques sont davantage impliquées : il s'agit notamment des fluoroquinolones, des macrolides, des cyclines, du cotrimoxazole et de certaines céphalosporines.
- Ne pas mélanger d'autres médicaments dans le même flacon de ce médicament.
- Ne pas utiliser de solutions bicarbonatées.
Les solutions les plus couramment utilisées comme diluants sont :
·Glucose à 5 % ou à 10 %, lévoglucose à 10 %, lévulose à 5 % ;
- ·Chlorure de sodium à 0,9 %, chlorure de sodium à 0,45 % + glucose à 2,5 %.
Comment réagir en cas de surdosage ?
Symptômes
Les symptômes de surdosage ne sont pas différents des effets indésirables décrits précédemment. Dans le cas d'un surdosage chronique, une dépression médullaire se manifestant par une thrombopénie ou une leucopénie ou une autre dyscrasie sanguine due à la carence en acide folique peut survenir.
Traitement
En fonction des symptômes, les mesures thérapeutiques suivantes peuvent être considérées : induction de l'excrétion rénale par diurèse forcée, hémodialyse (la dialyse péritonéale n'est pas efficace), surveillance hématologique et électrolytique.
Si une dyscrasie sanguine significative survient ou si un ictère apparaît, un traitement spécifique devra être institué pour ces complications. Des injections intramusculaires d'acide folinique peuvent être indiquées.
BACTRIM: Grossesse, allaitement et fertilité
Grossesse
L'utilisation de l'association sulfaméthoxazole/triméthoprime au cours du premier trimestre de grossesse n'est pas recommandée.
Les études effectuées chez l'animal ont mis en évidence un effet tératogène (voir rubrique Données de sécurité précliniques).
Des études épidémiologiques ont montré une augmentation du risque d'avortement spontané et de malformations congénitales, en particulier des anomalies de fermeture du tube neural et des fentes orales, chez les enfants de mère traitée par le triméthoprime pendant le 1er trimestre de grossesse. Le mécanisme d'action incriminé serait celui d'une interférence avec les folates. Néanmoins, si l'association sulfaméthoxazole-triméthoprime est utilisée en début de grossesseou chez les femmes envisageant une grossesse, une supplémentation en acide folique de 5 mg/jour doit être proposée pendant la durée du traitement sans évaluation à ce jour de son efficacité dans la prévention des anomalies évoquées.
Aux 2ème et 3ème trimestres, l'utilisation peut être envisagée si besoin. Néanmoins, durant le dernier trimestre de grossesse, Bactrim doit être évité autant que possible en raison du risque potentiel d'ictère nucléaire chez le nouveau-né.
En cas de déficit congénital en G6PD, la survenue d'une hémolyse néonatale est possible.
Allaitement
L'association triméthoprime-sulfaméthoxazole passe dans le lait maternel (voir rubrique Propriétés pharmacocinétiques).
L'allaitement est contre-indiqué dans le cas où la mère ou l'enfant présente un déficit en G6PD, afin de prévenir la survenue d'hémolyses.
De façon générale, l'allaitement est déconseillé en cas de traitement par Bactrim.
Fertilité
Sans objet
Autres informations
- Forme pharmaceutique: Solution injectable pour perfusion IV
- Voie d'administration: Iv
- Code ATC : J01EE01
- Classe pharmacothérapeutique : Sulfaméthoxazole et triméthoprime
- Conditions de prescription et de délivrance: Médicament retiré du marché le 24/01/2018
- Code Identifiant de Spécialité (CIS): 69233327
- Service médical rendu (SMR): Important
- Laboratoire titulaire AMM: Roche (02/03/1982)
- Laboratoire exploitant: Roche
Ce médicament n'appartient à aucun groupe générique.
- Résumé des Caractéristiques Produits (RCP) des autorisations de mise sur le marché (AMM) françaises et européennes
- Livret des interactions médicamenteuses de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM)
- Répertoire des génériques de l’ANSM
- Documents de référence de la Haute Autorité de Santé (HAS) : fiches de transparence, fiches de bon usage, documents SAM (Système d’Aide à la décision par Médicament)
- Prix et remboursements du Comité économique des produits de santé (CEPS)
- Informations des laboratoires titulaires de l’AMM (CF supra dans l’onglet « Autres informations » de cette page)
- Informations grossistes répartiteurs
- Assurance maladie (CNAMTS) : guide des affectations de longues durées (ALD)
- Agence technique de l'information sur l'hospitalisation (ATIH) : classification CIM10
- Organisation mondiale de la santé (OMS) : classification ATC
- Pharmacopée européenne : Standard Terms et classification EPhMRA
- Ministère de la santé : substances dopantes

/https%3A%2F%2Fprofilepics.canalblog.com%2Fprofilepics%2F4%2F2%2F426588.jpg)




/image%2F0964619%2F20240518%2Fob_e065e9_festival-du-livre-1920x1080-4-24-ecran.jpg)
/image%2F0964619%2F20240506%2Fob_4f0709_image-0991366-20181104-ob-95e079-jacqu.jpg)
/https%3A%2F%2Fstorage.canalblog.com%2F75%2F17%2F505612%2F129406040.jpeg)
/https%3A%2F%2Fstorage.canalblog.com%2F09%2F46%2F497307%2F133747489_o.jpg)